N.A.T. van der Maas, F. Mooi, G.A.M. Berbers, C. Swaan, S. de Greeff, H.E. de Melker
Sinds 1996 is er een aanzienlijke toename van kinkhoestmeldingen. De aanpassingen in het Rijksvaccinatieprogramma (RVP Rijksvaccinatie programma (Rijksvaccinatie programma)) om deze toename tegen te gaan, hebben effect gesorteerd op het vóórkomen van kinkhoest bij kinderen in de leeftijd van 3 maanden tot 8 jaar, kinderen die recent zijn gevaccineerd. Echter, bij zuigelingen die te jong zijn om te vaccineren blijft de incidentie aanzienlijk (~200 per 100.000). Onder adolescenten en volwassenen bij wie de kinkhoestimmuniteit is weggeëbd, is er een doorgaande stijging zichtbaar. De hoge incidentie van kinkhoest bij zuigelingen wordt waarschijnlijk veroorzaakt door de toename van kinkhoest bij volwassenen, waarmee het gunstige effect van vaccinatie van broertjes en zusjes op de jonge zuigeling weer teniet wordt gedaan. Op grond van nader onderzoek moeten aanpassingen in het RVP geïmplementeerd worden om de kinkhoestlast te verminderen.
Vanaf 1953 wordt er in Nederland gevaccineerd tegen kinkhoest, waarbij al die tijd een hoge vaccinatiegraad is behaald. (1) Desondanks is er vanaf 1996 een aanzienlijke toename in het aantal meldingen van kinkhoest zichtbaar, met elke 2-3 jaar een extra piek. (2, 3) Ook in andere landen is vanaf het eind van de vorige eeuw een toename zichtbaar. (4)
In Nederland zijn er verschillende maatregelen genomen om het aantal gevallen van kinkhoest terug te dringen, waarbij de nadruk lag op het beschermen van de jonge, (nog) niet volledig gevaccineerde zuigelingen. (Tabel 1) Zo is in 1999 het vaccinatieschema met een maand vervroegd en wordt de eerste vaccinatie op de leeftijd van 2 in plaats van 3 maanden gegeven. Verder krijgen vanaf oktober 2001 kinderen rond hun vierde verjaardag een boosterdosis met acellulair kinkhoestvaccin aangeboden. Tenslotte worden vanaf 1 januari 2005 alle baby’s gevaccineerd met een combinatievaccin, dat een acellulaire (aK acellulair kinkhoest (acellulair kinkhoest)) in plaats van een helecel(wcK)kinkhoestcomponent bevat. In dit artikel bespreken we aan de hand van surveillancedata of genoemde maatregelen effect hebben gehad en of aanvullende maatregelen nodig zijn om de ziektelast van kinkhoest terug te dringen.
Methoden
Het monitoren van het RVP is een essentieel instrument om het succes van het programma te evalueren. Onderstaande 5 pijlers worden gebruikt om de stand van zaken rond kinkhoest in kaart te brengen:
Klinische surveillance. Net als alle andere RVP-ziekten is kinkhoest aangifteplichtig en kinkhoestmeldingen worden centraal geregistreerd. Daarnaast worden ook de gegevens van de ziekenhuisopname- en de doodsoorzakenregistratie gebruikt om het vóórkomen van kinkhoest te monitoren.
Kiemsurveillance. Klinische isolaten worden genotypisch en fenotypisch gekarakteriseerd. Incidenteel wordt de volledige genoomsequentie van een stam bepaald. Op deze wijze kunnen verschuivingen in de bacteriepopulatie (tijdig) herkend worden en gerelateerd aan veranderingen in het vaccinatieprogramma en in de epidemiologie van kinkhoest.
Serosurveillance. Met behulp van een representatieve steekproef van de Nederlandse bevolking in de leeftijdsgroepen 0-80 jaar (n=8.000-10.000) kunnen de antistofniveaus specifiek gericht tegen B. pertussis in bloedmonsters bepaald worden en daarmee kan een schatting gemaakt worden van het aantal infecties. Via informatie uit de ingevulde vragenlijsten kan deze schatting ook gerelateerd worden aan klinische verschijnselen.
Vaccinatiegraad. Deze wordt bepaald met behulp van gegevens uit Praeventis, het landelijke vaccinatieregister. Voor kinkhoest worden deze gegevens ook gebruikt om de vaccineffectiviteit (VE vaccineffectiviteit (vaccineffectiviteit)) te schatten met behulp van de formule:
VE = 1 - PCV/(1-PVC polyvinylchloride (polyvinylchloride))*((1-PPV pneumokokken-polysaccharidevaccin (pneumokokken-polysaccharidevaccin))/PPV
Hierbij staat PCV voor het aantal gevaccineerde patiënten (proportion of cases vaccinated) en PPV voor de vaccinatiegraad in de bevolking (proportion of population vaccinated). Voor de VE van de zuigelingenvaccinatie wordt uitgegaan van een vaccinatiegraad van 96%, voor de boostervaccinatie bij 4 jaar gaan we uit van een vaccinatiegraad van 92%. Indien de PCV hoger is dan de PPV kan de VE niet geschat worden.

Monitoren van mogelijke bijwerkingen van de RVP-vaccinaties. Het registreren en beoordelen van spontane meldingen van mogelijke bijwerkingen van het RVP is sinds 2011 een taak van het Nederlands Bijwerkingen Centrum Lareb Landelijke Registratie Evaluatie Bijwerkingen (Landelijke Registratie Evaluatie Bijwerkingen). Vóór 2011 was dit ondergebracht bij het RIVM. Het RIVM voert ook epidemiologisch onderzoek uit naar mogelijke bijwerkingen, zoals vragenlijstonderzoeken bij wijzigingen in het programma of andere onderzoeksdesigns bij specifieke signalen.
Resultaten
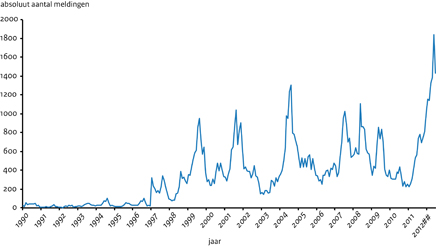
Sinds de veranderingen in het kinkhoestvaccinatieprogramma, geïmplementeerd vanaf 1999 tot en met 2005, is het totale aantal jaarlijkse kinkhoestgevallen niet duidelijk gereduceerd. (Figuur 1)
Leeftijdspecifieke incidenties
In figuur 2 wordt de leeftijdsspecifieke incidentie van kinkhoest in 2001 (voor invoering van de aK-booster voor vierjarigen) en de jaren 2004 (voor invoering van aK-vaccin bij zuigelingen), 2007 en 2008 (na invoering aK-vaccin bij zuigelingen) vergeleken met de incidentie van 2011 en de eerste 4 maanden van 2012. Al deze jaren hebben een vergelijkbare infectiedruk. De figuur laat het effect zien van de invoering van de booster op 4 jaar: in 2001 lag de piekincidentie bij 4- en 5-jarigen, in 2004 en volgende jaren ligt die piek bij oudere leeftijdsgroepen. (5) Ook de invoering van het aK- zuigelingenvaccin heeft effect gesorteerd: in de jaren na invoering (2007, 2008 en 2011) is de kinkhoestincidentie bij kinderen van 3 maanden tot 4 jaar duidelijk lager dan in de jaren voor invoering (2001 en 2004). De kinkhoestincidentie bij de jongste zuigelingen, die nog niet in aanmerking komen voor vaccinatie, is in 2012 sterk toegenomen. Hierbij moet worden opgemerkt dat de incidentie voor 2012 berekend is voor een relatief korte periode met een hoge infectiedruk, terwijl de cijfers over de andere jaren een jaargemiddelde weergeven. Ook is zichtbaar dat vanaf de leeftijd van ongeveer 8 jaar de incidentie weer toeneemt. De incidentie onder adolescenten en volwassenen steeg van 15 per 100.000 in 2001 tot 51 in de eerste 4 maanden van 2012.
Ziekenhuisopnames
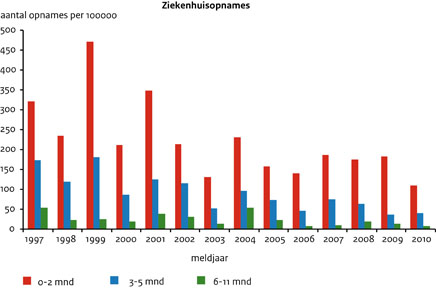
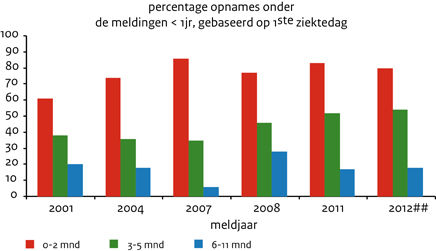
De introductie van het aK-vaccin voor zuigelingen in 2005 heeft geleid tot een afname van de incidentie van ziekenhuisopnames onder 0-jarigen van gemiddeld 86 per 100.000 voor 2002-2004 naar gemiddeld 60 per 100.000 voor 2005-2010. (Figuur 3A) Vanaf de leeftijd van 1 jaar daalt de leeftijdsspecifieke incidentie van ziekenhuisopnames snel; vanaf 5 jaar is de incidentie ≤ 1 per 100.000. Onder de meldingen is er een stijging zichtbaar van het percentage opgenomen baby’s van 3-5 maanden. (Figuur 3B) In absolute zin is er, na de introductie van het aK-vaccin voor zuigelingen in 2005, echter sprake van een afname van meldingen al dan niet met ziekenhuisopnames onder 0-2 en 3-5 maanden oude baby’s. (Tabel 2)
Figuur 1 Absoluut aantal meldingen per maand en jaar van 1990 tot 25-8-2012 met hierin aangegeven de aanpassingen in het RVP.
Figuur 2 Incidentie van wettelijke meldingen van kinkhoest per leeftijdsgroep voor de jaren 2001, 2004, 2007, 2008, 2011 en 2012. Incidenties over 2012 zijn berekend tot 25-8-2012.
Infectiefrequentie
Uit de 2 grootschalige serosurveillanceonderzoeken (Pienter 1 en 2) (6, 7) bleek dat het aantal infecties in de Nederlandse populatie met een factor 2 is toegenomen in 11 jaar. In de leeftijdscategorie ouder dan 9 jaar was de infectiefrequentie ruim 9% per jaar ten tijde van Pienter 2 (2006/7), wat neerkomt op ruim 1 miljoen infecties per jaar. Dit is een factor 100 meer dan de gemelde incidentie in 2006/7. Er is dus sprake van een enorme onderrapportage van kinkhoest, mede omdat veel infecties relatief mild verlopen. De grootste toename in kinkhoestinfecties werd gevonden in adolescenten en volwassenen. (8)
Vaccineffectiviteit
De geschatte VE van 1 tot 4-jarigen is toegenomen na de introductie van het aK-zuigelingenvaccin. Tijdens vaccinatie met het wcK-vaccin voor zuigelingen was de geschatte VE voor 2001 en 2004 gemiddeld 72%, 37% en 39% voor respectievelijk 1-, 2- en 3-jarigen. Na introductie van het aK-zuigelingenvaccin steeg de geschatte gemiddelde VE voor 2007, 2008, 2011 en 2012 naar 94%, 92% en 87% voor respectievelijk 1-, 2- en 3-jarigen.
De VE voor de boostervaccinatie op 4 jaar neemt af naarmate de vaccinatie langer geleden is toegediend (Figuur 4) en werd geschat op gemiddeld respectievelijk 85%, 79%, 65%, 62% en 56% in de eerste 5 jaren na vaccinatie.
Figuur 3a Incidentie van ziekenhuisopnames voor 0-2, 3-5 en 6-11 maanden-oude zuigelingen in 1997-2010.
Figuur 3b Percentage kinkhoestmeldingen waarvoor opname noodzakelijk was voor 0-2, 3-5, 6-11 maanden oude baby’s voor de jaren 2001, 2004, 2007, 2008, 2011 en 2012 tot 25-8-2012.
Kiemsurveillance
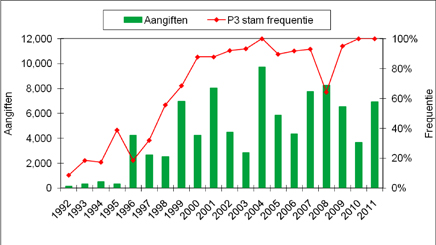
Uit de kiemsurveillance blijkt dat de B. pertussis-populatie een aantal veranderingen heeft ondergaan sinds de invoering van vaccinatie. (9) Vanaf 1960 is er antigene divergentie (een mismatch) opgetreden tussen circulerende stammen en de stammen die gebruikt worden voor vaccinproductie. Dit proces gaat door tot op de dag van vandaag. Begin 1990 zijn stammen opgekomen ( P3-stammen) die meer pertussis-toxine produceren. Aangezien pertussis-toxine de immunologische afweer onderdrukt, veronderstellen wij dat P3-stammen eerder in staat zijn om gevaccineerden te infecteren. Vanaf 2000 zien we een derde ontwikkeling, de opkomst van stammen die geen pertactine meer produceren, een van de componenten van acellulaire vaccins. De opkomst van de P3-stam is geassocieerd met de toename van kinkhoest in een aantal landen, waaronder Nederland. (10)
Bijwerkingen
Mogelijke bijwerkingen van kinkhoestvaccinatie worden elders in dit themanummer besproken.
Discussie
De surveillance van kinkhoest laat zien dat de maatregelen, die tot nu toe genomen zijn, kinkhoest hebben verminderd in de categorie die voor vaccinatie in aanmerking komt, kinderen van 3 maanden t/m 7 jaar. De gegevens tonen ook aan dat de beschermingsduur van de boostervaccinatie op 4 jaar beperkt is en na 4-5 jaren afneemt. Daarnaast is er een stijgende trend van kinkhoestmeldingen onder adolescenten en volwassenen die slechts in het eerste levensjaar zijn gevaccineerd met wcK-vaccin, waarbij er bovendien sprake is van een forse onderrapportage.
Kiemsurveillance laat zien dat de bacteriepopulatie aanzienlijk veranderd is sinds de invoering van vaccinatie. Gezien de aard van de veranderingen, is het aannemelijk dat de bacterie minder gevoelig is geworden voor vaccinatie. De opkomst van de P3-stammen die meer pertussis-toxine produceren, zou kunnen leiden tot ernstigere kinkhoestinfecties. Een toename in de virulentie van de kinkhoestbacterie wordt gesuggereerd door de relatieve toename van ziekenhuisopnames bij zuigelingen van 3-5 maanden oud. In Zweden is infectie met de P3-stam geassocieerd met een langere ziekenhuisopname duur. (11) De afname in incidentie van ziekenhuisopnames, zoals te zien in figuur 3A, lijkt in eerste instantie in tegenspraak met deze toegenomen virulentie. Mogelijk zijn deze incidenties echter vertekend door een afgenomen dekkingsgraad van deelnemende ziekenhuizen sinds 2005. Daarnaast is bekend dat broertjes en zusjes een belangrijke besmettingsbron zijn voor jonge zuigelingen en bij hen is de incidentie gedaald. Ook zorgt 1 dosis vaccin over het algemeen al voor een minder heftig ziektebeloop. (12) De vergelijking van het aantal opnames van 0-jarigen in de ziekenhuisregistratie en het aantal opnames onder de Osirismeldingen, toont een onderrapportage in de ziekenhuisregistratie.
Bij de verheffing, zoals die nu in het begin van 2012 optreedt, is ook de incidentie bij de jongste zuigelingen, die nog te jong zijn voor vaccinatie, toegenomen. Waarschijnlijk speelt een toenemende infectiedruk door volwassenen hierbij een belangrijke rol.
Een review van gegevens over de immuniteitsduur laat zien dat deze na een natuurlijke kinkhoestinfectie ongeveer 4-20 jaar aanhoudt, in vergelijking met een duur van 4-12 jaar na vaccinatie. (13) Iemand kan dus, ondanks vaccinatie, in de loop van het leven meerdere kinkhoestinfecties krijgen. Samen met de veranderingen in de bacteriepopulatie maakt dit een daling van de infectiefrequentie bij (jong) volwassenen in de toekomst minder waarschijnlijk, tenzij aanvullende maatregelen worden genomen. Hierdoor blijft de groep van (nog) niet volledig gevaccineerde zuigelingen ook op de lange duur kwetsbaar.

Figuur 4 Vaccineffectiviteit van de booster op 4 jarige leeftijd volgens de screeningsmethode in relatie tot tijd tussen vaccinatie en melding en geboortecohort.
Figuur 5 Trends in wettelijke meldingen en frequenties van de P3-stam voor 1992-2011.
Mogelijke interventies
Op korte termijn is het belangrijk dat publiek en professionals beter op de hoogte zijn van de epidemiologie van kinkhoest, zodat het beeld sneller en beter herkend wordt. Ook kan een nog betere tijdigheid van vaccinatie (ernstige) gevallen van kinkhoest voorkómen. (Woestenberg et al., in voorbereiding) Transmissieonderzoek toonde aan dat moeders een belangrijke besmettingsbron zijn voor zuigelingen. (10) Internationale studies bevestigen de belangrijke rol van volwassenen bij transmissie. (14, 15) Vaccinatie van moeders direct na de geboorte zou naar schatting 50% van de kinkhoest onder zuigelingen kunnen voorkomen. (de Greeff et al., submitted) Om de zuigeling verder te beschermen zou vaccinatie uitgebreid kunnen worden naar andere gezinsleden en zorgverleners die veelvuldig contact hebben met zuigelingen (cocooningstrategie). Een andere mogelijkheid om zuigelingen te beschermen is maternale vaccinatie, die inmiddels in de VS Verenigde Staten (Verenigde Staten) is toegestaan voor kinkhoest. (16) Op dit moment wordt een fase 1-onderzoek uitgevoerd, waarbij zwangere vrouwen Difterie-Tetanus-acellulair Pertussis of placebo krijgen. (http://clinicaltrials.gov/ct2/show/NCT00707148). Locht et al. zijn bezig met een fase 1-onderzoek met een nieuw levend verzwakt pertussis-vaccin voor intranasale toediening. (17) De resultaten van deze onderzoeken kunnen input geven aan een brede discussie over een nog betere bescherming van de jongste zuigelingen tegen kinkhoest.
Auteurs
N.A.T. van der Maas, F. Mooi, G.A.M. Berbers, C. Swaan,
S. de Greeff, H.E. de Melker, Centrum Infectieziektebestrijding, RIVM, Bilthoven
Correspondentie
N. van der Maas | nicoline.van.der.maas@rivm.nl
Literatuur
- Van Lier A. Vaccinatiegraad Rijksvaccinatieprogramma Nederland; Verslagjaar 2011. Bilthoven: National Institute for Public Health and the Environment2011. Report No.: 210021014/2011.
- de Melker HE, Conyn-van Spaendonck MA, Rumke HC, van Wijngaarden JK, Mooi FR, Schellekens JF. Pertussis in The Netherlands: an outbreak despite high levels of immunization with whole-cell vaccine. Emerg Infect Dis. 1997 Apr-Jun;3(2):175-8.
- de Melker HE, Schellekens JF, Neppelenbroek SE, Mooi FR, Rumke HC, Conyn-van Spaendonck MA. Reemergence of pertussis in the highly vaccinated population of the Netherlands: observations on surveillance data. Emerg Infect Dis. 2000 Jul-Aug;6(4):348-57.
- Berbers GA, de Greeff SC, Mooi FR. Improving pertussis vaccination. Hum Vaccin. 2009 Jul;5(7):497-503.
- de Greeff SC, Mooi FR, Schellekens JF, de Melker HE. Impact of acellular pertussis preschool booster vaccination on disease burden of pertussis in The Netherlands. Pediatr Infect Dis J. 2008 Mar;27(3):218-23.
- De Melker HE, Conyn-van Spaendonck MA. Immunosurveillance and the evaluation of national immunization programmes: a population-based approach. Epidemiol Infect. 1998 Dec;121(3):637-43.
- van der Klis FR, Mollema L, Berbers GA, de Melker HE, Coutinho RA. Second national serum bank for population-based seroprevalence studies in the Netherlands. Neth J Med. 2009 Jul-Aug;67(7):301-8.
- de Greeff SC, de Melker HE, van Gageldonk PG, Schellekens JF, van der Klis FR, Mollema L, et al. Seroprevalence of Pertussis in the Netherlands: Evidence for Increased Circulation of Bordetella pertussis. PLoS Plos One (Plos One) One. 2010;5(12):e14183.
- Mooi FR. Bordetella pertussis and vaccination: the persistence of a genetically monomorphic pathogen. Infect Genet Evol. 2010 Jan;10(1):36-49.
- Mooi FR, van Loo IH, van Gent M, He Q, Bart MJ, Heuvelman KJ, et al. Bordetella pertussis strains with increased toxin production associated with pertussis resurgence. Emerg Infect Dis. 2009 Aug;15(8):1206-13.
- Advani A, Gustafsson L, Carlsson RM risicomanagement (risicomanagement), Donnelly D, Hallander HO. Clinical outcome of pertussis in Sweden: association with pulsed-field gel electrophoresis profiles and serotype. APMIS. 2007 Jun;115(6):736-42.
- de Greeff SC, Mooi FR, Westerhof A, Verbakel JM Joint meeting (Joint meeting), Peeters MF, Heuvelman CJ, et al. Pertussis disease burden in the household: how to protect young infants. Clin Infect Dis. 2010 May 15;50(10):1339-45.
- Wendelboe AM, Van Rie A, Salmaso S, Englund JA. Duration of immunity against pertussis after natural infection or vaccination. Pediatr Infect Dis J. 2005 May;24(5 Suppl):S58-61.
- Bisgard KM, Pascual FB, Ehresmann KR, Miller CA, Cianfrini C, Jennings CE Conformité Européenne (Conformité Européenne), et al. Infant pertussis: who was the source? Pediatr Infect Dis J. 2004 Nov;23(11):985-9.
- Crowcroft NS Nederlandse Spoorwegen (Nederlandse Spoorwegen), Booy R, Harrison T, Spicer L, Britto J, Mok Q, et al. Severe and unrecognised: pertussis in UK United Kingdom (United Kingdom) infants. Arch Dis Child. 2003 Sep;88(9):802-6.
- Mooi FR, de Greeff SC. The case for maternal vaccination against pertussis. Lancet Infect Dis. 2007 Sep;7(9):614-24.
- Locht C, Mielcarek N. New pertussis vaccination approaches: en route to protect newborns? FEMS Immunol Med Microbiol. 2012 May 10.