In 2016 werden in Nederland 96 patiënten met listeriose geregistreerd; dit is een incidentie van 5,7 per miljoen inwoners. Onder de zieken waren 7 zwangere vrouwen (7%), maar het risico op het ontwikkelen van listeriose betrof vooral patiënten met ernstig onderliggend lijden en/of gebruik van immunosuppressiva of maagzuurremmers. Acht volwassenen zijn overleden (9%). Bij patiënten werden isolaten met serotypen 1/2a en 4b het meest aangetroffen; in voedsel was dit IIa (56%). Er werden een aantal PFGE (pulsed-field gel electroforese) (pulsed-field gel electroforese)-clusteringen tussen patiënt- en voedselisolaten gezien. Bij geen van de clusters was een directe link te leggen, wel geeft het inzicht in welke voedselproducten een besmettingsbron kunnen zijn.
ib oktober 2017
Auteurs: I.H.M. Friesema, S. Kuiling, M.E.O.C. Heck, E.G. Biesta-Peters, A. van der Ende, E. Franz
Infectieziekten Bulletin, jaargang 28, nummer 8, oktober 2017
Listeria monocytogenes is een bacterie die overal in het milieu voorkomt en daarbij ook onder ongunstige omstandigheden, zoals droogte en lage temperaturen, kan overleven. Besmetting van de mens gebeurt voornamelijk via voedsel. Het aantal mensen dat listeriose oploopt is niet heel groot, maar de ziektelast is hoog door de ernst van de ziekte op individueel niveau. (1) Bij zwangere vrouwen verloopt een Listeria-infectie meestal asymptomatisch of geeft een mild, griepachtig ziektebeeld, maar de infectie kan leiden tot spontane abortus, doodgeboorte, vroeggeboorte of ernstige neonatale ziekte. (2) Ouderen, mensen met een lage weerstand en pasgeboren baby’s lopen het grootste risico op een symptomatische infectie. Listeriose wordt gekenmerkt door onder andere gastro-enteritis, maar kan ook sepsis en meningitis veroorzaken waaraan patiënten kunnen overlijden. (3-5) In Nederland bestaat er sinds 2005 een laboratoriumsurveillance voor L. monocytogenes en een meldingsplicht sinds 2008. Daarnaast worden door de Nederlandse Voedsel en Waren Autoriteit (NVWA) jaarlijks diverse soorten risicovolle voedingsmiddelen op L. monocytogenes onderzocht. In deze rapportage presenteren we de resultaten van 2016 van beide surveillances en vergelijken die met elkaar en ten opzichte van voorgaande jaren.
Methode
Volgens de Wet Publieke Gezondheid (Wpg) (2008) is listeriose meldingsplichtig wanneer L. monocytogenes is geïsoleerd uit feces, bloed of liquor of (in geval van een zwangerschap) uit materiaal van een foetus, doodgeboren baby, pasgeboren baby of de moeder. Medisch microbiologische laboratoria dienen elke positieve kweek van L. monocytogenes te melden aan de regionale GGD (Gemeentelijke Gezondheidsdienst). De GGD neemt vervolgens contact op met de patiënt of naasten van de patiënt en neemt een korte vragenlijst af over medische achtergrond, klinisch beloop en blootstelling aan mogelijke risicofactoren in de 30 dagen voor het begin van de klachten. Deze gegevens worden via de webapplicatie Osiris geregistreerd bij het Rijksinstituut voor Volksgezondheid en Milieu (RIVM).
Daarnaast wordt de laboratoria gevraagd Listeria-isolaten van patiënten met meningitis of sepsis te sturen naar het Nederlands Referentielaboratorium voor Bacteriële Meningitis (NRBM) waar de isolaten getypeerd worden met serotypering. Er zijn meer dan 14 verschillende serotypes bekend voor L. monocytogenes. Slechts 4 serotypes, namelijk 1/2a, 1/2b, 1/2c en 4b, zijn verantwoordelijk voor >95% van alle humane infecties.
Het NRBM (Nederlands Referentielaboratorium voor Bacteri?le Meningitis) stuurt vervolgens de stammen door naar het RIVM waar de isolaten getypeerd worden met behulp van PFGE (pulsed-field gel electroforese). (6) Op basis van beide typeringen kan gezocht worden naar clusters. Clusteranalyse van de bandenpatronen wordt uitgevoerd met het softwarepakket BioNumerics® (Applied Maths, Sint-Martens-Laten, België) met als doel het identificeren van mogelijk epidemiologisch gerelateerde patiënten. Isolaten met minimaal 85% overeenkomstige fragmenten bij gebruik van het restrictie-enzym Asc-I worden ingedeeld in dezelfde Asc-I-groep en bij 100% identieke fragmenten krijgen deze isolaten ook hetzelfde Asc-I-type. Verder worden isolaten met tenminste 95% overeenkomstige fragmenten bij gebruik van het restrictie-enzym Apa-I in hetzelfde Apa-I-cluster ingedeeld. Isolaten met hetzelfde Asc-I-type en / of in hetzelfde Apa-I-cluster worden beschouwd als nauw verwante stammen. Isolaten die alleen in dezelfde Asc-I-groep zitten kunnen worden beschouwd als mogelijk verwante stammen.
De NVWA (Nederlandse Voedsel- en Warenautoriteit) onderzoekt jaarlijks diverse soorten risicovolle voedingsmiddelen op aanwezigheid van L. monocytogenes in het kader van haar toezichtstaak. Hieronder vallen onderzoeksprojecten met vooraf vastgelegde hoeveelheden en voedselproducten, maar ook het brononderzoek naar aanleiding van meldingen van voedselinfecties. Het L. monocytogenes-surveillanceonderzoek van de NVWA richt zich vooral op kant-en-klare levensmiddelen. Volgens Verordening (EG) nr. 2073/2005 mogen er in kant-en-klare levensmiddelen die in de handel zijn gebracht niet meer dan 100 kolonievormende eenheden (kve) L. monocytogenes per gram voorkomen gedurende de houdbaarheidstermijn. Kant-en-klare zuigelingenvoeding en kant-en-klare voeding voor medisch gebruik mogen geen L. monocytogenes bevatten (afwezigheid in 25 g). Daarnaast zijn in 2016 ook grotere aantallen vleesmonsters onderzocht op de aanwezigheid van L. monocytogenes en is er in feces van kleine herkauwers (schaap, geit) gekeken of L. monocytogenes aanwezig was.
De door de NVWA onderzochte monsters werden kwalitatief (detectie in 25 g) en/of kwantitatief (telling met detectielimiet 10 kve (kolonievormende eenheden)/g) onderzocht op aanwezigheid van L. monocytogenes (ISO 11290-1 en -2). Bij een geconstateerde afwijking van de norm zal de NVWA de verkoper en/of de producent op de hoogte brengen opdat deze een interventie kan plegen. Tevens voert de NVWA in het kader van haar bronopsporingstaak nader typeringsonderzoek uit op de door haar verkregen voedselisolaten. De door de NVWA verkregen voedselisolaten zijn getypeerd met behulp van moleculaire ‘serotypering’, een PCR (polymerase chain reaction)(polymerase chain reaction)-methode. Het verschil tussen klassieke serotypering (door het NRBM) en moleculaire serotypering (door de NVWA) is dat moleculaire serotypering alleen discrimineert tussen 5 gedefinieerde moleculaire serogroepen; IIa (=1/2a en 3a), IIb (=1/2b, 3b en 7), IIc (=1/2c en 3c), IVa (=4a en 4c) en IVb (=4b, 4d en 4e). (7, 8) Ondanks dit minder discriminerend vermogen van de moleculaire serotypering geeft deze methode toch een voldoende karakterisering en wordt veel gebruikt door verschillende medisch microbiologische laboratoria. Dit komt doordat de meest voorkomende serotypes 1/2a, 1/2b, 1/2c en 4b in een andere moleculaire serogroep vallen en dus van elkaar te onderscheiden zijn. Op basis van PFGE wordt, naast het identificeren van patiëntclusters, bekeken of mogelijke bronnen en patiënten aan elkaar te koppelen zijn. Daarnaast zijn de voedselisolaten ook onderling met elkaar vergeleken.
Resultaten
Aantal gerapporteerde patiënten en klinisch beeld
In 2016 werden 96 patiënten gerapporteerd met een infectie met L. monocytogenes. Dit komt overeen met een incidentie van 5,7 patiënten per miljoen inwoners (Figuur 1). Via Osiris werden 90 patiënten gemeld (van 59 werd ook een isolaat naar het NRBM gestuurd) en van 6 patiënten was alleen een isolaat ingestuurd. De mediane leeftijd van alle patiënten was 76 jaar (19-94 jaar) en 49% van de patiënten was man. De meest voorkomende ziektebeelden in 2016 zijn sepsis, meningitis, maagdarminfectie en longontsteking (Figuur 2). Sepsis werd het meest gemeld (27 patiënten), gevolgd door meningitis (18 patiënten). De zeldzamere ziektebeelden encefalitis en endocarditis werden ieder bij 1 patiënt gediagnosticeerd. Van 89 patiënten van wie het beloop van de infectie bekend was, zijn er 8 overleden (9%) met een mediane leeftijd van 75 jaar (47-90 jaar). Zes van deze 8 patiënten hadden sepsis en/of meningitis, de andere 2 patiënten hadden endocarditis of longontsteking. Zeven patiënten (7%) waren zwanger ten tijde van de Listeria-infectie, waarbij 1 zwangere vrouw een miskraam had, 2 baby’s doodgeboren werden, en 1 baby sepsis ontwikkelde en overleed. Van de overige 3 baby’s was er 1 prematuur, ontwikkelde 1 baby sepsis en had de derde baby voor zover bekend geen symptomen.
Figuur 1. Aantal patiënten met een L. monocytogenes infectie met bijbehorende incidentie, 2005-2016
Figuur 2. Verdeling van 4 belangrijkste ziektebeelden van listeriose, 2009-2016
Gegevens over risicofactoren
Mensen met onderliggend lijden en/of medicijngebruik hebben een verhoogd risico op listeriose. Drie mannen in de leeftijd 65-73 jaar hadden geen onderliggend lijden en gebruikten geen maagzuurremmers of immunosuppressiva, 1 van hen is overleden. 59% van de listeriosepatiënten gebruikte maagzuurremmers en bijna de helft (48%) slikte immunosuppressiva (Tabel 1); 26% van de patiënten slikte beide. De 3 meest genoemde onderliggende ziekten waren, evenals in voorgaande jaren, kanker, hart- en vaatziekten en diabetes.
In tabel 2 staan de meest geconsumeerde producten, waarvan bekend is dat ze besmet kunnen zijn met L. monocytogenes. Opvallend product in 2016 is rosbief dat door 35% van de patiënten gegeten is ten opzichte van 17-23% in de voorgaande jaren. De overige vleesproducten zijn minder of ongeveer evenveel gegeten ten opzichte van de voorgaande jaren. Bij de visproducten valt op dat gerookte zalm meer gegeten (37%) is dan in 2012-2015 (17-31%). Zachte kazen zijn door 54% gegeten en is daarmee het meest genoemde voedingsmiddel, meer dan in de voorgaande jaren (31-52%).
Tabel 1. Osiris-gegevens over onderliggend lijden en medicijngebruik bij patiënten met een L. monocytogenes-infectie, 2012-2016
|
Onderliggende condities en medicijngebruik |
2016 n / N (%) |
2015 n / N (%) |
2014 n / N (%) |
2013 n / N (%) |
2012 n / N (%) |
|---|---|---|---|---|---|
|
Diabetes |
18 / 88 (20) |
14 / 68 (21) |
13 / 88 (15) |
17 / 71 (24) |
7 / 64 (11) |
|
Leverziekte |
10 / 88 (11) |
3 / 68 (4) |
3 / 88 (3) |
4 / 71 (6) |
2 / 64 (3) |
|
Nierziekte |
11 / 88 (13) |
10 / 68 (15) |
11 / 88 (13) |
13 / 71 (18) |
4 / 64 (6) |
|
Hart- en vaatziekten |
21 / 88 (24) |
16 / 68 (24) |
17 / 88 (19) |
16 / 71 (23) |
13 / 64 (20) |
|
Kanker |
26 / 88 (30) |
20 / 68 (29) |
30 / 88 (34) |
20 / 71 (28) |
24 / 64 (38) |
|
Immuunstoornis |
7 / 88 (8) |
5 / 68 (7) |
11 / 88 (13) |
3 / 71 (4) |
8 / 64 (13) |
|
Longziekte |
4 / 88 (5) |
3 / 68 (4) |
9 / 88 (10) |
5 / 71 (7) |
6 / 64 (9) |
|
Maagdarmziekte |
5 / 88 (6) |
5 / 68 (7) |
7 / 88 (8) |
5 / 71 (7) |
4 / 64 (6) |
|
Transplantatie-orgaan |
3 / 88 (3) |
2 / 68 (3) |
4 / 88 (5) |
4 / 71 (6) |
1 / 64 (2) |
|
Reuma |
6 / 88 (7) |
6 / 68 (9) |
13 / 88 (15) |
6 / 71 (8) |
7 / 64 (11) |
|
Alcoholmisbruik |
7 / 88 (8) |
4 / 68 (6) |
3 / 88 (3) |
2 / 71 (3) |
1 / 64 (2) |
|
Andere ziekte |
10 / 88 (11) |
7 / 68 (10) |
7 / 88 (8) |
12 / 71 (17) |
8 / 64 (13) |
|
Medicijngebruik: Immunosuppressiva Maagzuurremmers |
39 / 82 (48) 42 / 71 (59) |
26 / 58 (45) 34 / 47 (72) |
50 / 84 (60) 38 / 67 (57) |
35 / 62 (56) 24 / 55 (44) |
37 / 60 62) 28 / 49 (57) |
|
Geen onderliggend condities |
3 / 88 (3) |
4 / 67 (6) |
6 / 88 (7) |
1 / 72 (1) |
2 / 67 (3) |
Tabel 2. Osiris-gegevens over activiteiten en voedselconsumptie* in de 30 dagen vóór de klachten bij patiënten met een L. monocytogenes-infectie, 2012-2016
|
Risicofactoren |
2016 n / N (%) |
2015 n / N (%) |
2014 n / N (%) |
2013 n / N (%) |
2012 n / N (%) |
|
|
Activiteiten |
||||||
|
Reis buitenland |
1 / 85 (1) |
2 / 66 (3) |
3 / 85 (4) |
2 / 68 (3) |
1 / 67 (1) |
|
|
Voedselconsumptie |
||||||
|
Worst/worstjes |
24 / 62 (39) |
19 / 41 (46) |
32 / 67 (48) |
20 / 48 (42) |
20 / 52 (38) |
|
|
Filet americain |
16 / 62 (26) |
12 / 41 (29) |
16 / 67 (24) |
6 / 48 (13) |
13 / 52 (25) |
|
|
Rosbief |
22 / 62 (35) |
7 / 41 (17) |
13 / 67 (19) |
9 / 48 (19) |
12 / 52 (23) |
|
|
Paté |
16 / 62 (26) |
7 / 41 (17) |
17 / 67 (25) |
13 / 48 (27) |
5 / 52 (10) |
|
|
Gekookte/gerookte ham |
26 / 62 (42) |
19 / 41 (46) |
32 / 67 48) |
20 / 48 (42) |
15 / 52 (29) |
|
|
Kip/kalkoen vleeswaren |
23 / 62 (37) |
16 / 41 (39) |
31 / 67 (46) |
18 / 48 (38) |
18 / 52 (35) |
|
|
Hamburger |
15 / 62 (24) |
|||||
|
Gerookte zalm |
23 / 62 (37) |
11 / 44 (25) |
12 / 69 (17) |
16 / 51 (31) |
14 / 53 (26) |
|
|
Haring |
17 / 62 (27) |
16 / 44 (36) |
19 / 69 (28) |
16 / 51 (31) |
18 / 53 (34) |
|
|
Kibbeling/lekkerbek |
16 / 62 (26) |
13 / 44 (30) |
17 / 69 (25) |
14 / 51 (28) |
13 / 53 (25) |
|
|
Totaal zachte kazen |
34 / 63 (54) |
17 / 46 (37) |
31 / 72 43) |
28 / 54 (52) |
17 / 54 (31) |
Onderzoek levensmiddelen
In 2016 werden door de NVWA circa 4100 (partijen van) levensmiddelen kwalitatief en kwantitatief onderzocht op de aanwezigheid van L. monocytogenes. Hierbij werden 212 isolaten gevonden.
90% van de isolaten werd gevonden met de kwalitatieve methode, waarbij het besmettingsniveau onder de 100 kve/gram ligt. De grotere aantallen isolaten, ten opzichte van andere jaren, die gevonden werden, zijn toe te schrijven aan het starten van onderzoek op nieuwe matrices (kip, kleine herkauwers) en door onderzoek van grotere aantallen visproducten in het kader van een uitbraak. Hier heeft gerichte bemonstering plaatsgevonden, waardoor er een bias voor de matrix vis mogelijk is.
Uit vers rundvlees werden 24 stammen geïsoleerd (n=301) en uit rauw te consumeren vlees, 33 stammen (n=318). Veel stammen werden geïsoleerd uit vers pluimveevlees: 397 monsters onderzocht waarvan 34 kalkoen- en 59 kipmonsters positief waren. Van 300 onderzochte mestmonsters van landbouwhuisdieren waren 36 positief. 60 monsters van rood vlees uit koel- en vrieshuizen werden onderzocht waarbij 16 positief testten (1 keer lam en 15 keer rund). Enkele stammen werden geïsoleerd uit paté, vleeswaren, visproducten (zalm, haring, forel), tofu, tahin, humus en sushi. Er werden geen stammen geïsoleerd uit rauwmelkse zuivel (n=30), vleesvervangers (n=80), kiemgroenten (n=20), tapas (n=309) of ijs uit ijsssalons (n=305).
Serotypering van patiënt- en voedselisolaten
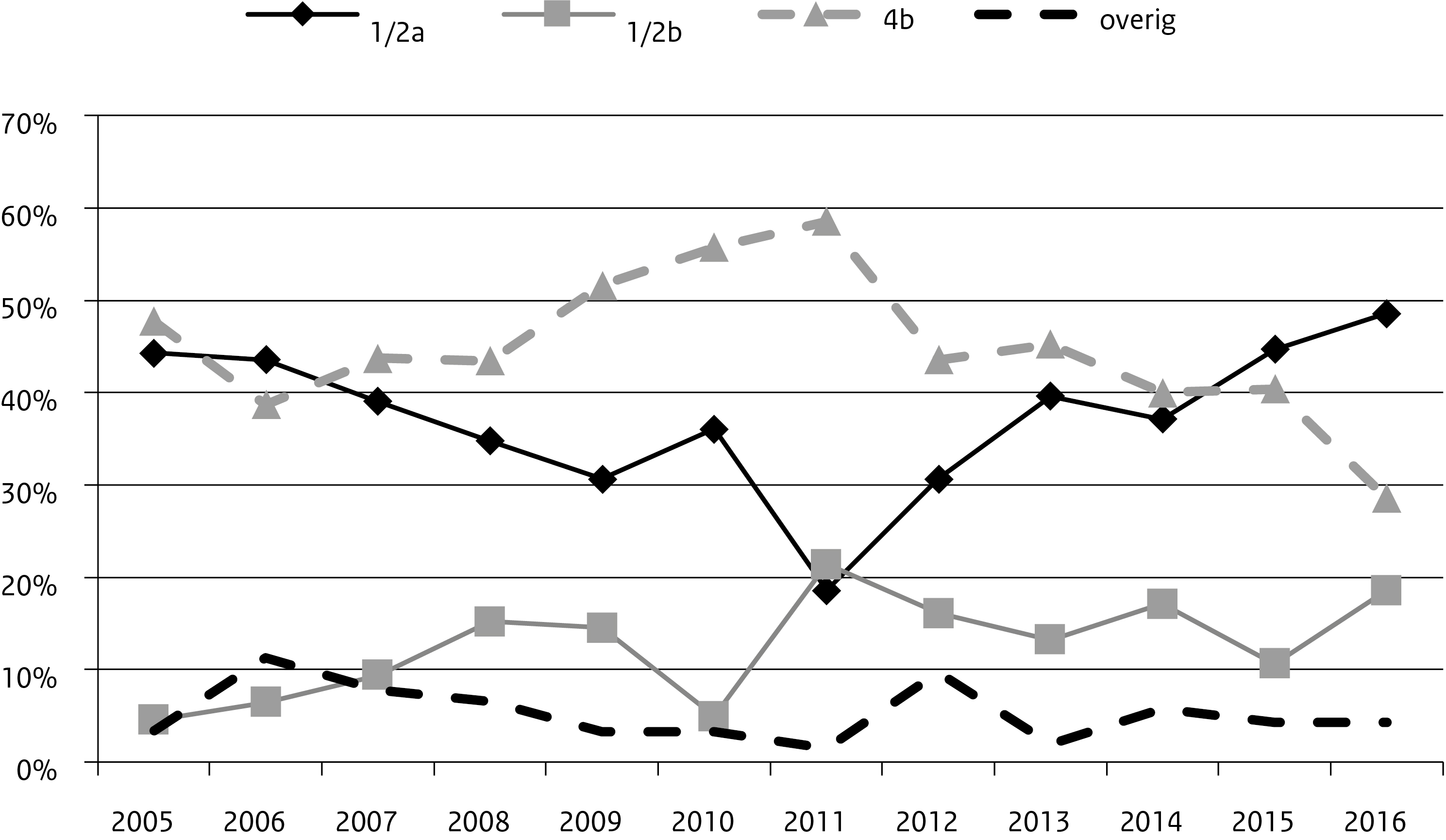
Het NRBM ontving isolaten van 70 patiënten voor bevestiging en serotypering. De meeste isolaten waren gevonden in bloed (77%), liquor (4%) en bloed en liquor (13%). De 4 overige isolaten waren afkomstig uit ascites, galvocht, hersenabces en vagina. L. monocytogenes serotype 1/2a werd bij 49% van de patiënten geïsoleerd en is daarmee, evenals in 2015, het meest gevonden serotype, gevolgd door 4b (29%) en 1/2b (19%) (Figuur 3). Serotypes 3a en 1/2c werden respectievelijk 2 en 1 keer aangetoond.
Door de NVWA zijn 212 isolaten gevonden in unieke (partijen van) monsters. Het ging hierbij om: 27 isolaten in vis (21 zalm, 3 haring, 3 forel), 27 in feces van kleine herkauwers, 88 in pluimvee (57 kip, 31 kalkoen), 37 in rundvlees, 29 in vleeswaren (16 in filet américan, 8 in ossenworst, 5 in overig) en 4 in tofu, tahin, hunus en sushi. Op basis van moleculaire serotypering konden de isolaten worden ingedeeld in verschillende serogroepen: 118 stammen hadden serotype IIa (55%), 42 stammen serotype IIc (20%), 21 stammen serotype IIb (10%), 28 stammen serotype IVb (13%) en 3 stammen serotype IVa (1%). Hiermee is serotype IIa het meest voorkomende serotype in het onderzochte voedsel, maar dit percentage ligt lager dan voorgaande jaren. De verdeling van de serotypes over de verschillende voedselgroepen is weergegeven in tabel 3.
Figuur 3. Serotypering van de humane isolaten, 2005-2016
Tabel 3. Verdeling van de serotypes over de verschillende groepen onderzocht voedsel
|
Aantal isolaten |
IIa |
IIb |
IIc |
IVa |
IVb |
|
|---|---|---|---|---|---|---|
|
Feces kleine herkauwers |
27 |
12 |
6 |
1 |
8 |
|
|
Vis |
27 |
23 |
1 |
3 |
||
|
zalm |
21 |
17 |
1 |
3 |
||
|
haring |
3 |
3 |
||||
|
forel |
3 |
3 |
||||
|
Pluimvee |
88 |
65 |
3 |
14 |
2 |
4 |
|
kip |
57 |
39 |
3 |
11 |
1 |
3 |
|
kalkoen |
31 |
26 |
3 |
1 |
1 |
|
|
Rundvlees |
37 |
9 |
5 |
17 |
6 |
|
|
Tahin |
1 |
1 |
||||
|
Tahoe |
1 |
1 |
||||
|
Tofu |
1 |
1 |
||||
|
Tapas |
1 |
1 |
||||
|
Vleeswaren |
29 |
8 |
6 |
9 |
6 |
|
|
filet american |
16 |
4 |
3 |
5 |
4 |
|
|
ossenworst |
8 |
3 |
3 |
2 |
||
|
overig* |
5 |
1 |
4 |
|||
|
Totaal |
212 |
118 |
21 |
42 |
3 |
28 |
Clusteranalyse
Van de isolaten van 70 patiënten was een PFGE-patroon beschikbaar. Er werden 11 patiëntclusters geïdentificeerd met in totaal 25 patiënten (9 clusters van 2 patiënten, een cluster van 3 en een cluster van 4 patiënten). In 7 van de clusters was het PFGE-patroon al sinds 2009 bij minimaal 1 patiënt gedetecteerd. Zeven van de patiëntclusters lieten geen clustering in regio en tijd (minimaal 4 weken tussen de eerste ziektedagen) zien en bij 1 cluster was er wel clustering in regio, maar niet in tijd. In het cluster van 4 patiënten waren 2 patiënten met de eerste ziektedag binnen 2 weken, maar was er verder geen clustering te zien. In het cluster met 3 patiënten werd de diagnose binnen 1 week gesteld, zonder clustering in regio; helaas was er slechts van 1 patiënt informatie over consumptie van voedselproducten beschikbaar. In het laatste cluster van 2 patiënten lagen de eerste ziektedagen 5 dagen uit elkaar, woonden de patiënten ongeveer 40 kilometer uit elkaar en waren geen gegevens over voedselconsumptie beschikbaar.
Van alle voedselisolaten was een PFGE-patroon beschikbaar en daarin waren 11 clusters te zien: 3 clusters van 3 isolaten, 3 clusters van 4 isolaten, 1 cluster van 5 isolaten, 1 cluster van 6 isolaten, 2 clusters van 7 isolaten en 1 cluster van 10 isolaten.
Het cluster van 10 isolaten bestond uit 4 isolaten uit kip, 4 uit kalkoen, 2 uit rund, bemonsterd in diverse supermarkten en slagerijen gedurende het hele jaar en over meerdere regio’s van het land. Het cluster van 7 isolaten bestond uit isolaten uit zalm, bemonsterd in dezelfde maand. Het cluster van 6 isolaten bestond uit 4 isolaten uit feces van schaap/geit, 1 uit kipfilet en 1 uit rundvlees. De overige, kleinere clusters bestonden allemaal uit isolaten uit dezelfde categorieën producten per cluster.
Zes PFGE-patronen in voedsel-/dierisolaten werden ook gezien in patiëntisolaten. In 3 gevallen ging het om clustering met een cluster van 2 patiënten:
- filet américain, waarbij 1 patiënt dit niet gegeten had en van de tweede geen voedselanamnese beschikbaar was;
- sukadelap, waarbij de bemonstering enkele maanden na de eerste ziektedag van de patiënten was en dit vleesproduct niet standaard wordt nagevraagd bij de patiënten;
- meerdere isolaten uit kalkoen-, kip- en rundvlees, maar geen voedselanamnese beschikbaar van beide patiënten.
De 3 andere gevallen kwamen elk overeen met het patroon in 1 patiëntisolaat:
- ossenworst en rundvlees, waarbij de patiënt biefstukworst heeft gegeten; de patiënt werd enkele maanden voor de positieve voedselproducten ziek, wel kwam de bemonsterde ossenworst uit dezelfde regio als de patiënt;
- rundvlees, maar geen voedselanamnese beschikbaar;
- isolaten uit feces van schaap en geit, maar geen informatie beschikbaar over contact met schapen en geiten en geen clustering in regio van de schaap-/geitbedrijven en de patiënt.
Discussie
Na een lager aantal meldingen in 2015 (72 patiënten), ligt het aantal meldingen in 2016 even hoog als in 2014, met 96 patiënten. Sinds de invoering van de meldingsplicht eind 2008 lag de incidentie van gerapporteerde listeriose tussen 4,3 en 5,6 patiënten per miljoen inwoners. In 2016 lag deze incidentie net iets hoger met 5,7 per miljoen. Het sterftepercentage lag in 2015 met 22% juist hoger dan in voorgaande jaren. In 2016 is dit weer gedaald naar 9%, wat vergelijkbaar is met de jaren 2009-2014 (5-12%) met als uitzondering 2010 (20%). In 2016 werden 7 zwangere vrouwen met listeriose gemeld, dit is meer dan de 3 zwangere vrouwen per jaar in 2013-2015, maar vergelijkbaar met 2012 (n=6) en 2011 (n=9). Naast de meldingsplicht worden de beschikbare Listeria-stammen voor typering naar het NRBM en RIVM gestuurd. Het percentage stammen dat niet vergezeld ging van een officiële melding is voor het vierde jaar met 6% stabiel (2016: 6/96; 2015: 4/72; 2014: 6/95; 2013: 5/79). Hoewel het om kleine aantallen gaat, blijft er dus sprake van onderrapportage.
Met behulp van de surveillance en de meldingsplicht kunnen trends in incidentie, patiëntkenmerken en risicofactoren gevolgd worden en eventuele uitbraken gedetecteerd worden. Het identificeren van risicovolle producten via surveillance of patiëntcontroleonderzoek is lastig, onder andere omdat Listeria overal voor kan komen en de besmettingsgraad van producten sterk kan wisselen. Daarnaast spelen patiëntkenmerken, zoals onderliggend lijden en gebruik van immunosuppressiva en maagzuurremmers, een belangrijke rol in wie wel en wie niet ziek wordt na het eten van een besmet product. Een methode om risicovolle producten te identificeren is clusteranalyse (9) op basis van de positieve voedselproducten uit de onderzoeken van de NVWA en de patiëntisolaten. In 2016 werd, met behulp van PFGE, een aantal kleine clusters van maximaal 4 patiënten gevonden. Daarnaast werden 6 PFGE-clusteringen tussen patiënt- en voedselisolaten, voornamelijk uit vleesproducten, gezien. Bij geen van de clusters was een directe link te leggen. Wel geeft het inzicht welke voedselproducten een besmettingsbron kunnen zijn. Daarnaast kan het zo zijn dat er sprake is van een indirecte link via de procesomgeving. In een fabriek waar vlees wordt verwerkt kan immers een persistente L. monocytogenes op verschillende producten voorkomen. Hierdoor is op basis van tijd en plaats een link niet aannemelijk, maar op basis van productielocatie wel.
Sinds 2006 zijn elk jaar, met behulp van PFGE, de humane isolaten vergeleken met de voedselisolaten Een andere methode om meer inzicht te krijgen, is het gebruik van whole genome sequencing (WGS). In andere landen wordt deze methode al bij uitbraken gebruikt. (10, 11) Vanaf 2017 wordt WGS (Whole Genome Sequence) ook in Nederland gebruikt voor typering van de humane isolaten en ook de NVWA gaat WGS gebruiken. Op deze wijze kunnen clusters onderscheiden worden die met de huidige methoden niet van elkaar te onderscheiden zijn. Ook kan met een grotere mate van zekerheid een link tussen isolaten uit patiënten en uit voedsel worden vastgesteld, ook wanneer die op basis van tijd en locatie niet aannemelijk lijkt. Dit kan meer inzicht geven in de voedselproducten die ziekte veroorzaken en de verspreiding van de verschillende stammen in tijd en plaats.
| Alle GGD’en en medisch microbiologische laboratoria worden hartelijk bedankt voor hun medewerking bij de verzameling van de patiëntengegevens en het insturen van isolaten, en alle patiënten voor hun medewerking bij het beantwoorden van de vragen, onder vaak moeilijke omstandigheden. Tenslotte bedanken we de personen binnen het RIVM (met name Henny Maas) voor hun werk aan de isolatie en typering van Listeria monocytogenes, de onderzoeksondersteuners van het laboratorium Voeder- en Voedselveiligheid van de NVWA voor het onderzoeken van de monsters en Ingeborg van der A-Zuurveen, Caroliene van Heerwaarden en Nathalie te Loeke voor het serotyperen van de isolaten en het analyseren van de PFGE-patronen. |
Auteurs
I.H.M. Friesema1, S. Kuiling1, M.E.O.C. Heck1,
E.G. Biesta-Peters2, A. van der Ende3, E. Franz1
- Centrum Infectieziektebestrijding, RIVM
- Divisie Consument en Veiligheid, NVWA
- Nederlands Referentielaboratorium voor Bacteriële Meningitis, AMC (Academisch Medisch Centrum Amsterdam)
Correspondentie
Alle GGD’en en medisch microbiologische laboratoria worden hartelijk bedankt voor hun medewerking bij de verzameling van de patiëntengegevens en het insturen van isolaten, alsook alle patiënten voor hun medewerking bij het beantwoorden van de vragen onder vaak moeilijke omstandigheden. Tenslotte bedanken we de personen binnen het RIVM (met name Henny Maas) voor hun werk aan de isolatie en typering van Listeria monocytogenes, de onderzoeksondersteuners van het laboratorium Voeder- en Voedselveiligheid van de NVWA voor het onderzoeken van de monsters en Ingeborg van der A-Zuurveen, Caroliene van Heerwaarden en Nathalie te Loeke voor het serotyperen van de isolaten en het analyseren van de PFGE-patronen.
- Maertens de Noordhout C, Devleesschauwer B, Angulo FJ, et al. The global burden of listeriosis: a systematic review and meta-analysis. The Lancet Infectious diseases 2014.
- Wadhwa Desai R, Smith MA. Pregnancy-related listeriosis. Birth Defects Res 2017; 109: 324-35.
- Charlier C, Perrodeau E, Leclercq A, et al. Clinical features and prognostic factors of listeriosis: the MONALISA national prospective cohort study. The Lancet Infectious diseases 2017.
- Todd ECD (Elektronisch cli?ntendossier), Notermans S. Surveillance of listeriosis and its causative pathogen, Listeria monocytogenes Food Control 2011; 22: 1484-90.
- Doganay M. Listeriosis: Clinical presentation. FEMS Immunol Med Microbiol 2003; 35: 173-5.
- Pulsenet International. Standard operating procedure for Pulsenet PFGE (pulsed-field gel electroforese) of Listeria Monocytogenes. 2013. (http://www.pulsenetinternational.org/assets/PulseNet/uploads/pfge/PNL04_ListeriaPFGEProtocol.pdf). (Accessed 16 maart 2016 2016).
- Doumith M, Buchrieser C, Glaser P, Jacquet C, Martin P. Differentiation of the major Listeria monocytogenes serovars by multiplex PCR (polymerase chain reaction). J Clin Microbiol 2004; 42: 3819-22.
- Kerouanton A, Marault M, Petit L, Grout J, Dao TT, Brisabois A. Evaluation of a multiplex PCR assay as an alternative method for Listeria monocytogenes serotyping. J Microbiol Methods 2010; 80: 134-7.
- Dalton CB, Merritt TD, Unicomb LE, et al. A national case-control study of risk factors for listeriosis in Australia. Epidemiol Infect 2011; 139: 437-45.
- Schmid D, Allerberger F, Huhulescu S, et al. Whole genome sequencing as a tool to investigate a cluster of seven cases of listeriosis in Austria and Germany, 2011-2013. Clin Microbiol Infect 2014; 20: 431-6.
- Jensen AK, Nielsen EM, Bjorkman JT, et al. Whole-genome sequencing used to investigate a nationwide outbreak of listeriosis caused by ready-to-eat delicatessen meat, Denmark, 2014. Clin Infect Dis 2016; 63: 64-70.