I.H.M. Friesema, C.M. de Jager, A.E. Heuvelink, W.K. van der Zwaluw, S. Kuiling, J.T.M. Zwartkruis, W. van Pelt In 2010 werden 52 patiënten met een STEC (Shigatoxineproducerende E. coli-stammen)-O157-infectie gediagnosticeerd, wat neerkomt op 0,32 ziektegevallen per 100.000 inwoners (1999-2009: 0,22-0,35 per 100.000, exclusief uitbraken). In 2010 werden ook 81 patiënten met een STEC non-O157-infectie gediagnosticeerd: meest gevonden O-groepen waren O63(13), O91(8), O26(6) en O103(6). Van de STEC-O157-patiënten werd 49% opgenomen in een ziekenhuis (33-54% in eerdere jaren) ten opzichte van 16% van de STEC non-O157-patiënten (11-14% in 2008-2009). Drie kinderen met een STEC-O157-infectie (6%; 2-21% in eerdere jaren) en 1 kind met een STEC-O26-infectie ontwikkelden het hemolytisch-uremisch syndroom (HUS). Uit de vergelijking van de cases met de controles kwam consumptie van rauw/ongaar vlees, met name filet américain als risicofactor voor STEC non-O157-infecties naar voren. Op basis van de testuitslagen van de laboratoria die ook STEC non-O157 kunnen detecteren, wordt geschat dat het daadwerkelijke aantal STEC non-O157-infecties in 2010 in Nederland 2,3 keer hoger lag dan het aantal STEC O157-infecties.
Shigatoxineproducerende Escherichia coli (STEC), met als meest bekende serogroep O157, is een bekende verwekker van maagdarmklachten met symptomen variërend van ongecompliceerde diarree tot hemorragische colitis en het hemolytisch-uremisch syndroom (HUS). Vooral bij kleine kinderen en ouderen treden complicaties op. (1-4) De lage infectieuze dosis van STEC (Shigatoxineproducerende E. coli-stammen)-O157, 1-100 bacteriën, leidt makkelijk tot uitbraken, zoals in Nederland in 2005, 2007 en 2009. (5-7) Herhaaldelijk wordt benadrukt dat ook STEC non-O157-uitbraken kan veroorzaken, met als meest recente voorbeeld de O104-uitbraak in Duitsland. (8)
Vanwege de ernst van de ziekte, vooral bij kleine kinderen en ouderen, en het risico op epidemische verspreiding, is in Nederland in januari 1999 de geïntensiveerde surveillance van STEC-O157 van start gegaan en zijn sinds december 1999 STEC-infecties meldingsplichtig. In 2007 is de intensieve surveillance uitgebreid met STEC non-O157, waarbij opgemerkt moet worden dat niet alle Nederlandse laboratoria technieken gebruiken die het mogelijk maken STEC non-O157 te detecteren. In dit artikel presenteren we de resultaten van de surveillance voor het jaar 2010.
Methoden
Cases
Binnen de aangifte dient elke positieve bevinding van STEC (op basis van fecesonderzoek of serologie) door het laboratorium gemeld te worden aan de lokale GGD (Gemeentelijke Gezondheidsdienst). De GGD verzamelt aan de hand van een standaardvragenlijst informatie over het klinische beeld bij de patiënt en blootstelling aan bekende risicofactoren. Bij een vermoeden van een bron wordt contact opgenomen met de nieuwe Voedsel en Waren Autoriteit (nVWA) voor monster-afname en onderzoek naar STEC, en typering van eventuele isolaten. E. coli (Escherichia coli)-kolonies worden door de laboratoria opgestuurd naar het RIVM. Op het RIVM worden alle ingestuurde E. coli- O157 en mogelijke STEC non-O157-isolaten met behulp van PCR (polymerase chain reaction) (polymerase chain reaction) getest op de aanwezigheid van de belangrijkste virulentiegenen en vervolgens getypeerd met O- en H- serotypering. Tenslotte worden DNA (deoxyribonucleic acid)-fingerprints van STEC-O157 isolaten gemaakt door middel van pulsed field gel electroforese (PFGE).
Controles
Sinds juli 2008 wordt elke 3-4 maanden een vragenlijst met vergelijkbare vragen als die in de standaardvragenlijst voor de patiënt naar telkens een nieuwe aselecte steekproef van controlepersonen gestuurd. Gegevens uit de vragenlijst van de 3 zendingen van 2010 (februari, juni, oktober) zijn vergeleken met de antwoorden uit de vragenlijsten van de STEC-patiënten. Daarnaast zijn de STEC-patiënten uit 2008 tot en met 2010 samen vergeleken met de zendingen uit dezelfde jaren.
Resultaten
Meldingen
In 2010 werden 498 patiënten gemeld via de aangifte en/of het insturen van een isolaat. (Tabel 1) Van 335 van de 498 patiënten werden isolaten naar het RIVM gestuurd, waarvan bij 133 de aanwezigheid van Shigatoxine(stx)genen in de ingestuurde isolaten kon worden bevestigd. In totaal werden 375 van de 498 patiënten (75%) gemeld via de aangifte, waarbij het laboratorium in 74% van de gevallen binnen 24 uur de positieve bevinding aan de GGD had doorgegeven. Bij 7 patiënten werd gemeld dat ze HUS (hemolitisch uremisch syndroom) hadden ontwikkeld. Echter, van 2 patiënten is geen stam ingestuurd en van 1 kon de STEC-infectie niet bevestigd worden bij het RIVM. Bij de overige 4 HUS-patiënten werd bij 3 een STEC- O157- infectie en bij 1 een STEC-O26 aangetoond. De verdere resultaten worden beperkt tot de 133 bevestigde STEC-infecties.
Tabel 1: Aantal gemelde patienten met een STEC-infectie en HUS in Nederland in 2009 en 2010
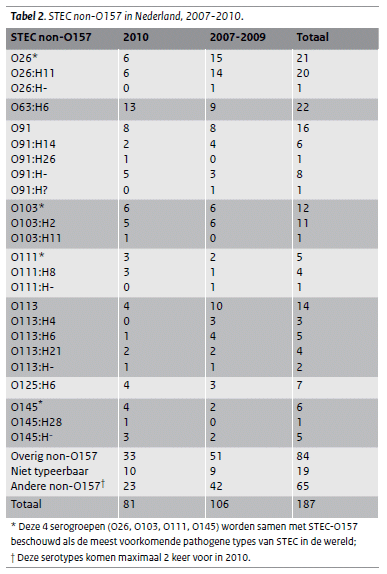
Tabel 2: STEC-non O-157 in Nederland 2007-2010
Typering van isolaten
Serotypering van de 133STEC-isolaten leverde 52 keer serogroep O157 op. De meeste isolaten in 2010 (64%) bevatte zowel stx1 als stx2, 34% droeg alleen het stx2-gen en 1 isolaat (2%) alleen het stx1-gen. Alle O157-isolaten bevatten het H7-gen, of dit gen ook tot expressie komt, is in 2010 niet getest. Alle isolaten hadden het E. coli attaching and effacing gen (eae) en het EHEC (Enterohemorragische Escherichia coli)-hemolysinegen (e-hly).
Van de 81 STEC non-O157-isolaten was 10 keer de O-groep niet typeerbaar. Bij de overige 71 isolaten werden 28 verschillende O-groepen gevonden. O63:H6 kwam in 2010 het meest voor (tabel 2), gevolgd door O91, O26 en O103. Van de 81 STEC non-O157-isolaten bevatten 32 isolaten alleen het stx1-gen, 37 isolaten alleen het stx2-gen (waarvan 22 het stx2f-gen) en 12 isolaten bevatten beide genen. In totaal 18 isolaten hadden het eae (E. coli attaching-and-effacing)- en het e-hly-gen, 22 isolaten hadden alleen het eae-gen, 21 isolaten alleen het e-hly-gen en 20 isolaten geen van beide genen.
Demografische kenmerken en vragenlijst-gegevens van de patiënten met een bevestigde STEC-infectie
Onder de patiënten met een STEC-O157-infectie (69%; 1999-2009: 39-62%), maar ook onder de patiënten met een STEC non-O157-infectie (58%; 2009: 59%) waren meer vrouwen dan mannen. De oververtegenwoordiging van vrouwen was leeftijdsonafhankelijk. Vergelijking van de leeftijd van de STEC-O157-patiënten met voorgaande jaren laat zien dat het aandeel van kinderen gedaald is. (Figuur 1a). Was in de periode 1999-2009 ongeveer de helft van de patiënten jonger dan 20 jaar, in 2010 is dit een derde. Onder de STEC non-O157-patiënten in 2010 waren relatief veel 20-29 jarigen, bleef het aandeel 0-4 jarigen hoog en daalde het aantal 60-plussers ten opzichte van 2008 en 2009. (Figuur 1b). Van de STEC-O157-patiënten in 2010 werd 73% ziek in de maanden juli tot en met september ten opzichte van gemiddeld 44% in de voorgaande jaren. (Figuur 2a). Figuur 2b laat zien dat STEC non-O157-infecties vooral in de tweede helft van het jaar plaats lijken te vinden. In 2010 werd 49% van de STEC-O157-patiënten opgenomen in het ziekenhuis (1999-2009: 33%-54%) en 16% van de STEC non-O157-patiënten (2009: 11%; 2008: 14%). Een jongen en een meisje, beiden 10 jaar, en een meisje van 2 jaar ontwikkelden HUS als gevolg van een STEC-O157-infectie (6%; 2% in 2009 en 8-21% in de jaren ervoor). Daarnaast werd een jongetje van 2 jaar gemeld met HUS en een STEC-O26-infectie. Een man van 58 jaar en een vrouw van 64 jaar zijn overleden aan de gevolgen van een STEC-O157-infectie.
Figuur 1a: Percentage patiënten per leeftijdsgroep voor STEC-O157 exclusief de patienten van de utibraken in 2005, 2007 en 2009
Figuur 1 b: Percentage patiënten per leeftijdsgroep voor STEC non- O157
Figuur 2a Percentage patiënten per maand voor STEC-O157 (1999-2009 en 2010) exclusief de patienten van de uitbraken in 2005, 2007, 2009.
Figuur 2b Percentage patienten per maand voor STEC non -O157 (2008-2010)
Doormelden van een positieve bevinding door het laboratorium aan de GGD vond voor 77% van de bevestigde STEC-patiënten plaats binnen de wettelijk vereiste 24 uur (O157 = 31/46; non-O157 = 45/53). In totaal zijn 34 (26%) van de bevestigde infecties niet officieel gemeld door de betreffende GGD (6 keer O157 en 28 keer non-O157), voor 2 van deze 28 patiënten met een STEC non-O157- infectie is wel een surveillancevragenlijst ingevuld. Voor 32 (62%) van de STEC-O157-patiënten en 31 (38%) van de STEC non-O157-patiënten in 2010 werd een vragenlijst ingestuurd. De tijd tussen de eerste ziektedag van de patiënt en het invullen van de vragenlijst was voor STEC-O157 mediaan 13 dagen (4-32 dagen) ten opzichte van 13 tot 21 dagen in voorgaande jaren. Voor STEC non-O157 was de mediaan 31 dagen (7-177 dagen) ten opzichte van 30-33 dagen in 2008-2009.
De meest gerapporteerde klachten in de vragenlijst bij een STEC-O157-infectie zijn diarree (100%), buikpijn en/of buikkramp (93%) en bloed in de ontlasting (72%). Voor STEC non-O157-infecties waren dit diarree (84%) en buikpijn en/of buikkramp (87%). Op het moment van invullen van de vragenlijst had nog 34% (O157) en 45% (non-O157) van de patiënten klachten. Bij degenen die hersteld waren, had de ziekte mediaan 9 dagen (range 2-16 dagen, O157) of 15 dagen (2-175 dagen, non-O157) geduurd.
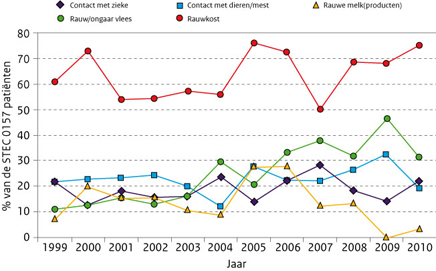
Zowel consumptie van rauw vlees als contact met dieren/mest is in 2010 gedaald ten opzichte van 2009, terwijl consumptie van rauwkost en contact met zieken voorafgaand aan eigen ziekte iets zijn gestegen onder patiënten met een STEC-O157-infectie. (Figuur 3) Vergelijking van de risicofactoren tussen STEC-O157, STEC non-O157 en controlepersonen leverde voor 2010 geen significante risicofactoren op. Analyse van de data over 2008 tot en met 2010 liet alleen consumptie van rauw vlees, met name filet américain (odds ratio: 2,5 met 95% betrouwbaarheidsinterval van 1,4-4,4) zien als risicofactor voor STEC non-O157.
Figuur 3: Percentage STEC-O157 patienten per risicofactor per jaar (1999-2010) exclusief de STEC-O157 patienten van de uitbraken in 2005, 2007, 2009
Nader onderzoek naar mogelijke bronnen van infectie
Naar aanleiding van een HUS-patiënt heeft de nVWA onderzoek verricht op de boerderij waar het meisje woont. In de mest van runderen werd STEC O157 geïsoleerd met een match op basis van het PFGE (pulsed-field gel electroforese)-patroon met het humane STEC-O157-isolaat.
PFGE-clusteranalyse STEC-O157
Met behulp van Pulsed field gel electrophoresis (PFGE) kunnen 8 clusters in 2010 onderscheiden worden. Bij 2 clusters, 1 van 3 patiënten en 1 van 5 patiënten (waarvan 3 uit 1 gezin) is er een duidelijke clustering in regio en tijd, maar zijn er geen verdere aanwijzingen voor een gezamenlijke bron. De stam die bij zowel een patiënt als in rundermest is aangetroffen, blijkt 4 maanden eerder al bij een ander kind in een andere regio gevonden te zijn. Bij de overige 5 clusters is een gemeenschappelijke bron niet aannemelijk of ontbrak de informatie voor verdere analyse.
Discussie
De incidentie van laboratorium bevestigde STEC-O157 is stabiel en varieert tussen 0,22-0,35 ziektegevallen per 100.000 inwoners (exclusief uitbraken) en was in 2010 0,32 per 100.000 inwoners. De incidentie van laboratoriumbevestigde STEC non-O157 is lastiger te berekenen, omdat niet alle laboratoria testmethodes gebruiken waarmee alle STEC gedetecteerd kunnen worden. In 2010 stuurden 30 laboratoria monsters in, waarvan er 15 alle STEC kunnen detecteren. Deze laatste laboratoria waren verantwoordelijk voor 67% van de bevestigde STEC-O157-meldingen. De verhouding O157: non-O157 binnen deze laboratoria is 1: 2,3. Dit is lager dan in 2008 (1: 3,5), 2009 (1: 3,6) en de Nederlandse pilotstudie in 2005/2006 (1: 4) (10, 11). Omgerekend naar heel Nederland zou dit voor 2010 uitkomen op 120 STEC non-O157-infecties wat correspondeert met een incidentie van 0,74 ziektegevallen per 100.000 inwoners. Echter, de hier gegeven incidenties is een onderschatting van de werkelijke incidentie van STEC-O157 en non-O157, omdat niet iedereen dermate ziek zal worden dat hij een arts bezoekt, een arts niet altijd diagnostiek zal aanvragen en bij een laboratoriumaanvraag niet altijd onderzoek gedaan zal worden naar STEC. Er bestaat overigens niet de indruk dat dit de lage incidentie in Nederland ten opzichte van andere Europese landen (12) zou kunnen verklaren.
STEC non-O157 is een heterogene groep pathogenen, waarbij opvalt dat, vergeleken met STEC-O157, de ziekte gemiddeld minder ernstig verloopt. Dit valt op te maken uit het percentage ziekenhuisopnames en het voorkomen van bloederige diarree. Aan de andere kant kan een STEC non-O157 ook ernstig verlopen, wat bewezen werd door een kind dat HUS ontwikkelde bij een STEC-O26- infectie en de uitbraak van O104 in Duitsland met een hoog percentage HUS onder de patiënten (8). Wereldwijd zijn O26, O103, O111 en O145 de meest bekende types naast O157 (13, 14). In Nederland stonden in 2010 O26 en O103 op een gedeelde derde plaats, voorafgegaan door O63 en O91. Bijzonder aan O63 is dat dit type altijd het stx2f-gen bezat. Tot voor kort werd aangenomen dat stx2f niet belangrijk was voor humane infecties en vrijwel alleen voorkwam bij duiven. (15) In totaal bezat in 2008 en 2009 22% van de STEC non-O157 dit gen, in 2010 was dit 27%. Dit laat zien dat ook stx2f kan leiden tot humane infecties.
Uitbraken hebben laten zien dat consumptie van rauw rundvlees en rauwkost belangrijke risicofactoren voor STEC-infecties zijn (6-8, 16-18). Echter, vergelijking van individuele patiënten met controles laat dat niet zien, behalve rundvlees voor STEC non-O157. Mogelijk dat besmetting van voedsel niet vaak voorkomt, maar als het gebeurt, dit meteen leidt tot een uitbraak. Bij de individuele patiënten spelen mogelijk meer potentiële bronnen een rol, waardoor dit moeilijker aan te tonen is. Bronopsporing is hierbij een belangrijk instrument, zoals bijvoorbeeld in 2010 waarbij voor een patiënt de bron gevonden werd door een match met het rundvee op de boerderij waar de patiënt woont. Ook andere vormen van onderzoek kunnen mogelijke oorzaken aanduiden, zoals het verband tussen regionale runderdichtheid en STEC-O157-infecties in de zomer bij jonge kinderen via een ecologische studie. (19)
Sinds de invoering van PCR-technieken door verschillende laboratoria en de uitbreiding van de surveillance met STEC-non- O157 is het aantal onbevestigde monsters sterk gestegen. In de periode 2008-2010 kon ruim 60% van de ingestuurde isolaten niet bevestigd worden. De uitbreiding heeft er toe geleid dat de GGD‘en in de gebieden met laboratoria die gebruik maken van PCR beduidend meer meldingen binnenkrijgen. Het is moeilijk om medewerkers te motiveren om voor alle gemelde patiënten een surveillancevragenlijst in te vullen voordat dat er een uitslag is en daarom wordt er meestal gewacht tot deze binnen is. Hierdoor zit er meer tijd tussen eerste ziektedag en invullen van de vragenlijst. Daarnaast is ook de druk op het RIVM toegenomen door de toegenomen aantallen (meestal negatieve) isolaten. Deze situatie is duidelijk niet optimaal en er moet beslist gaan worden welke aanpak de beste combinatie tussen inspanning en opbrengst oplevert. Belangrijk daarbij is dat alle partijen achter de gekozen aanpak staan.
Conclusie
STEC non-O157-infecties in Nederland zijn wat betreft incidentie minstens zo belangrijk als STEC-O157-infecties. Wat betreft ziektelast lijken de STEC non-O157-infecties gemiddeld een minder ernstig verloop te hebben, wat echter mede afhankelijk is van welke O-groepen gevonden worden. Op O-groepniveau blijft STEC-O157 in Nederland nog steeds het belangrijkste O-type, maar zolang de surveillance van STEC non-O157 (nog) niet landelijk dekkend is, is het inzicht hierover nog onvoldoende.
Dankwoord
Alle GGD’en en medisch microbiologische laboratoria worden hartelijk bedankt voor hun medewerking bij de verzameling van de patiëntgegevens en het insturen van isolaten. Daarnaast worden de medewerkers van de nVWA bedankt voor het onderzoek naar landbouwhuisdieren en verdacht voedsel.
Auteurs
I.H.M. Friesema 1, C.M. de Jager 1, A.E. Heuvelink 2, W.K. van der Zwaluw 1, S. Kuiling 1, J.T.M. Zwartkruis 2, W. van Pelt 1
- Centrum Infectieziektebestrijding, RIVM, Bilthoven
- nieuwe Voedsel en Waren Autoriteit, Regionale dienst Oost, Zutphen
Correspondentie:
I.H.M. Friesema | ingrid.friesema@rivm.nl
Literatuur
- Paton JC, Paton AW. Pathogenesis and diagnosis of Shiga toxin-producing Escherichia coli infections. Clin Microbiol Rev 1998;11(3):450-79.
- Nataro JP, Kaper JB. Diarrheagenic Escherichia coli. Clin Microbiol Rev 1998;11(1):142-201.
- Reiss G, Kunz P, Koin D, Keeffe EB. Escherichia coli O157:H7 infection in nursing homes: review of literature and report of recent outbreak. J Am Geriatr Soc 2006;54(4):680-4.
- Karmali MA. Host and pathogen determinants of verocytotoxin-producing Escherichia coli-associated hemolytic uremic syndrome. Kidney International 2009;75(SUPPL. 112).
- Doorduyn Y, de Jager CM, van der Zwaluw WK, et al. Shiga toxin-producing Escherichia coli (STEC) O157 outbreak, The Netherlands, September - October 2005. Euro Surveill 2006;11(7):182-5.
- Friesema I, Sigmundsdottir G, van der Zwaluw K, et al. An international outbreak of shiga toxin-producing Eschericha coli O157 infection due to lettuce, September-October 2007. Euro Surveill 2008;13(50):18-22.
- Greenland K, de Jager C, Heuvelink A, et al. Nationwide outbreak of STEC O157 infection in the Netherlands, December 2008-January 2009: continuous risk of consuming raw beef products. Euro Surveill 2009;14(8).
- Askar M, Faber MS (Multiple Sclerose), Frank C, et al. Update on the ongoing outbreak of haemolytic uraemic syndrome due to Shiga toxin-producing Escherichia coli (STEC) serotype O104, Germany, May 2011. Euro Surveill 2011;16(22):pii=19883.
- Schuurman T, Roovers A, van der Zwaluw WK, et al. Evaluation of 5’-nuclease and hybridization probe assays for the detection of shiga toxin-producing Escherichia coli in human stools. J Microbiol Methods 2007;70(3):406-15.
- Van Duynhoven YTHP, Friesema IHM, Schuurman T, et al. Prevalence, characterization and clinical profiles of Shiga toxin-producing Escherichia coli in the Netherlands. Clin Microbiol Infect 2008;14:437-45.
- Friesema IHM, de Jager CM, Heuvelink AE (alveolaire echinokokkose), et al. Intensieve surveillance van Shiga toxine producerende Escherichia coli in Nederland, 2009. Infectieziekten Bulletin 2011;22(1):22-9.
- European Centre for Disease Prevention and Control. Annual epidemiological report on communicable diseases in Europe 2010. Stockholm: European Centre for Disease Prevention and Control, 2010.
- Perelle S, Dilasser F, Grout J, Fach P. Screening food raw materials for the presence of the world’s most frequent clinical cases of Shiga toxin-encoding Escherichia coli O26, O103, O111, O145 and O157. Int J Food Microbiol 2007;113(3):284-8.
- Johnson KE, Thorpe CM, Sears CL. The emerging clinical importance of non-O157 shiga toxin-producing Escherichia coli. Clin Infect Dis 2006;43(12):1587-95.
- Prager R, Fruth A, Siewert U, Strutz U, Tschäpe H. Escherichia coli encoding Shiga toxin 2f as an emerging human pathogen. Int J Med Microbiol 2009;299(5):343-53.
- Sodha SV, Lynch M, Wannemuehler K, et al. Multistate outbreak of Escherichia coli O157:H7 infections associated with a national fast-food chain, 2006: a study incorporating epidemiological and food source traceback results. Epidemiol Infect 2011;139(2):309-16.
- King LA, Filliol-Toutain I, Mariani-Kurkidjian P, et al. Family outbreak of Shiga toxin-producing Escherichia coli O123:H-, France, 2009. Emerg Infect Dis 2010;16(9):1491-3.
- Sekse C, O’Sullivan K, Granum PE, Rorvik LM, Wasteson Y, Jorgensen HJ. An outbreak of Escherichia coli O103:H25 - Bacteriological investigations and genotyping of isolates from food. Int J Food Microbiol 2009;133(3):259-64.
- Friesema IH, J VDK, CM DEJ, Heuvelink AE, W VANP. Geographical association between livestock density and human Shiga toxin-producing Escherichia coli O157 infections. Epidemiol Infect 2011;139(7):1081-7.