Ziekenhuisinfecties met meticillineresistente Staphylococcus aureus (MRSA) zijn geassocieerd met hoge mortaliteit en kosten. Om deze redenen is het belangrijk om MRSA (Methicilline-resistente Staphylococcus aureus)- infecties zoveel mogelijk te voorkomen. In 2008 werd 0.7% van alle S. aureus bacteriëmieën in Nederlandse ziekenhuizen veroorzaakt door MRSA. (3) De belangrijkste reden voor deze lage prevalentie is het MRSA-beleid (ook wel search-and-destroybeleid genoemd) dat in de huidige vorm sinds 1988 wordt toegepast in de Nederlandse ziekenhuizen en is vastgelegd in de richtlijn van de Werkgroep Infectie Preventie (WIP). (4) De maatregelen zijn destijds gebaseerd op 2 epidemiologische kenmerken: MRSA-dragerschap bij gezonde mensen is verwaarloosbaar en de belangrijkste risicofactor voor MRSA-dragerschap is opname in een buitenlands ziekenhuis. Hoewel effectief, vraagt het beleid veel inspanning van medewerkers in de gezondheidszorg en gaat het gepaard met hoge kosten. (5) Recent zijn zowel de epidemiologie van MRSA als de diagnostische mogelijkheden om dragerschap aan te tonen in belangrijke mate veranderd en het is dan ook tijd voor een kritische beschouwing.
Veranderingen in epidemiologie – veegerelateerde MRSA (Methicilline-resistente Staphylococcus aureus)
Sinds de eerste beschrijving van de zogenaamde veegerelateerde MRSA in 2005 is duidelijk geworden dat deze MRSA-kloon (ook wel MRSA-ST398 genoemd) wijd verbreid voorkomt in de Nederlandse veestapel: 69% en 88% van de varkens- en vleeskalverhouderijen bleek besmet met MRSA en mensen die intensief contact hebben met levende varkens en vleeskalveren waren in respectievelijk 29% en 33% van de gevallen gekoloniseerd met MRSA. (6,7)
Deze bevindingen leidden in juli 2006 tot aanpassing van de MRSA-richtlijn: (beroepsmatig) contact met varkens of vleeskalveren werd toegevoegd aan de risicofactoren voor MRSA-dragerschap. MRSA-dragerschap werd door middel van screening aangetoond bij 12% tot 15% van de mensen die tot deze risicocategorieën behoren (tabel 1). (8,9) Hiermee is een risicogroep voor MRSA-dragerschap ontstaan, waarvoor eradicatie van MRSA niet zinvol is door de persisterende frequente beroepsmatige expositie aan MRSA. Hierdoor zal een MRSA-reservoir blijven bestaan. Uit een grote Nederlandse multicentrische studie blijkt echter dat de veegerelateerde MRSA-stam zich veel minder goed verspreidt in Nederlandse ziekenhuizen dan de ziekenhuisgeassocieerde MRSA. Het relatieve risico op verspreiding van veegerelateerde MRSA in ziekenhuizen, in verhouding tot ziekenhuisgeassocieerde MRSA was 0,28 in een groot Nederlands multicentrisch onderzoek.(10) De genotypespecifieke RA -waarde (basis reproductiegetal van 1 ziekenhuisopname) werd geschat op 0,16 voor veegerelateerde MRSA en 0,68 tot 0,93 voor ziekenhuisgeassocieerde MRSA. (11) De RA-ratio tussen ziekenhuisgeassocieerde - en veegerelateerde MRSA was 5,90, waaruit blijkt dat veegerelateerde MRSA zich bijna 6 keer minder goed verspreidt dan ziekenhuisgeassocieerde MRSA.
Risico in klassieke risicocategorieën
Tot de klassieke risicocategorieën voor MRSA-dragerschap in Nederland behoren patiënten die behandeld werden in een buitenlands ziekenhuis en patiënten die contact hebben gehad met een MRSA-drager. Tussen 1998 en 2001 was 4,7% van de patiënten die uit buitenlandse ziekenhuizen gerepatrieerd werden naar Nederlandse ziekenhuizen MRSA-drager. (12) In een recent verrichte multicentrische studie in Nederland (uitgevoerd van 2005 tot 2008) was echter slechts 1,6% (20/1251) van de klinische patiënten, die werden gescreend vanwege eerdere behandeling in een buitenlands ziekenhuis, MRSA-drager (volgens de geldende richtlijnen, dus bijvoorbeeld ook patiënten gerepatrieerd naar huis) (tabel 1). (9) Bij patiënten die gescreend werden in het kader van klinisch contactonderzoek vanwege een onverwacht gedetecteerde ziekenhuisgeassocieerde MRSA-drager, ligt de MRSA-
prevalentie tussen 1,7% (33/1951) en 2,3% (8/342) (tabel 1). (9,10) Ook bij 4794 ziekenhuismedewerkers die gescreend werden in klinisch contactonderzoek waren slechts 29 medewerkers (0,6%) gekoloniseerd met een genotypisch stam identiek aan die van de indexpatiënt. (10) De kans op transmissie van ziekenhuisgeassocieerde MRSA tussen klinische patiënten en naar ziekenhuismedewerkers is dus erg klein en MRSA-kolonisatie bij patiënten die behandeld zijn in buitenlandse ziekenhuizen (en met een onbekende MRSA-status) komt veel minder vaak voor dan voorheen werd verondersteld.
Snellere diagnostiek voor aantonen MRSA
Tot enkele jaren geleden kon MRSA alleen aangetoond worden met conventionele microbiologische kweekmethoden, waardoor de uitslag pas 3 tot 5 dagen later bekend was. Tot die tijd bleven patiënten met MRSA-verdenking in (pre-emptieve) isolatie. Aangezien het merendeel van deze patiënten niet gekoloniseerd was met MRSA, verbleef meer dan 95% dus een aantal dagen onnodig in isolatie. (12)
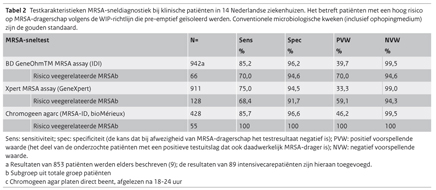
Inmiddels is het mogelijk om binnen enkele uren vast te stellen of er sprake is van MRSA-kolonisatie. Dat kan met behulp van testen op basis van PCR (polymerase chain reaction) (uitslag binnen enkele uren) of door middel van chromogene agarkweekmethoden (uitslag binnen 24 uur). Voor een MRSA-screeningstest is het belangrijk dat de negatief voorspellende waarde (NVW: het deel van de onderzochte patiënten met een negatieve testuitslag en dus geen MRSA-drager is) hoog is en dit is het geval voor de onderzochte sneltesten in Nederlandse ziekenhuizen (IDI PCR, GeneXpert PCR, MRSA-ID) (tabel 2). (9) De isolatiemaatregelen kunnen dus veilig worden opgeheven als de uitslag van een MRSA-sneltest negatief is. Uiteraard hangt de hoge NVW samen met de lage prevalentie van MRSA in de gescreende risicogroep: met de lage MRSA-prevalentie in hoogrisicopatiënten in Nederland heeft iedere test een NVW van 97%. Aan een positieve MRSA-sneltest kunnen echter geen definitieve conclusies worden verbonden, omdat alle sneltesten frequent fout-positieve uitslagen genereren. (9) Dit is in de praktijk een beperkt probleem zolang naast de sneltest ook een conventionele kweek wordt ingezet, zodat een fout-positief resultaat van de sneltest na enkele dagen gecorrigeerd kan worden.
De geschatte sensitiviteit (de kans dat de test een positieve uitslag geeft bij mensen die MRSA-drager zijn) van MRSA-sneldiagnostiek zoals uitgevoerd in de meeste Nederlandse ziekenhuizen (screening van neus, keel, perineum en eventuele wonden etc.) varieert tussen 75% (GeneXpert PCR) en 85% (IDI PCR en MRSA-ID) (met conventionele kweek als referentie). (9) Hierbij moet worden opgemerkt dat de sensitiviteit van de MRSA-PCR voor veegerelateerde stammen respectievelijk 68% en 70% is voor de GeneXpert- PCR en IDI-PCR, terwijl de gevoeligheid van de chromogene media 100% is (tabel 2).
Voordelen van MRSA-sneldiagnostiek
Het grote voordeel van MRSA-sneldiagnostiek in Nederland is dat pre-emptieve isolatiemaatregelen bij MRSA-verdachte personen snel kunnen worden opgeheven als zij geen drager blijken te zijn. In een Nederlands multicentrisch onderzoek kon het aantal isolatiedagen worden teruggebracht met 48% (chromogeen agar) en 60% (MRSA-PCR). (9)
Theoretisch is het mogelijk een verdere afname van het aantal pre-emptieve isolatiedagen met moleculaire methoden te bereiken. In de dagelijkse praktijk werd dit niet gerealiseerd vanwege een aantal redenen. Ten eerste is de doorlooptijd van start van de isolatiemaatregelen tot het bekend worden van het PCR-resultaat 14,0 tot 22,2 uur. (9,13-16) Ten tweede zijn er frequent fout-positieve PCR-resultaten waarna pre-emptieve isolatie gehandhaafd blijft. De laatste reden is dat bij contactonderzoek cohortisolatie wordt ingesteld, waarbij alle patiënten op een zaal gescreend moeten worden. Bij methoden met een beperkte capaciteit neemt dit extra tijd in beslag.
Tenslotte, omdat isolatiemaatregelen geassocieerd zijn met ongewenste negatieve gevolgen voor patiënten (17) wordt dit argument gebruikt om het belang van het terugbrengen van onnodige pre-emptieve isolatiedagen te benadrukken. Echter, uit een een studie uitgevoerd in het UMC (Universitair Medisch Centrum) Utrecht bleek dat kortdurende isolatiemaatregelen geen nadelige gevolgen hadden voor het geestelijk welzijn van gehospitaliseerde patiënten. (18) In deze studie zijn kortdurende isolatiemaatregelen onderzocht, omdat langdurige isolatiemaatregelen alleen worden toegepast bij patiënten die daadwerkelijk gekoloniseerd blijken met MRSA en dit wordt door het verrichten van MRSA-sneldiagnostiek niet teruggebracht. Het argument dat MRSA-sneldiagnostiek het welzijn van de patiënt ten goede komt, kan daarom niet gebruikt worden.
Nadelen van MRSA-sneldiagnostiek
Natuurlijk hebben de nieuwe testtechnieken ook nadelen. Het MRSA-chromosoom kan veranderen waardoor deze stammen niet meer gedetecteerd kunnen worden met de moleculaire methoden. Verder kunnen sommige moleculaire testen (bijvoorbeeld IDI-PCR) alleen uitgevoerd worden door specifiek geschoold personeel. Ook zijn, door de beperkte capaciteit van de GeneXpert- PCR of IDI-PCR, deze methoden minder geschikt voor grote contactonderzoeken of uitbraken. Deze nadelen van de moleculaire testen zijn niet van toepassing op de chromogene media, die eenvoudig in de routine van een diagnostisch microbiologisch laboratorium kunnen worden opgenomen en waarbij geen problemen gelden met detectie van veegerelateerde MRSA. Het belangrijkste nadeel van de chromogene agar is dat de doorlooptijd tot een uitslag langer is dan van de MRSA PCR. Een ander nadeel van MRSA-sneldiagnostiek zijn de hogere kosten, vooral van de moleculaire technieken, in vergelijking tot de conventionele kweekmethoden.
Kosteneffectiviteit van MRSA-sneldiagnostiek
Of het Nederlandse search-and-destroybeleid ook kosteneffectief is bij gebruik van MRSA-sneldiagnostiek voor MRSA-screening was onbekend. Uit een Nederlands multicentrische studie uitgevoerd op verpleegafdelingen in 14 ziekenhuizen bleek dat de kosten om 1 isolatiedag te besparen €95,77 en €125,43 waren bij gebruik van respectievelijk de IDI-PCR en GeneXpert-PCR. Bij gebruik van chromogene media werden deze kosten geschat op €6,74. De additionele kosten van één extra dag isolatiemaatregelen op een verpleegafdeling in een niet-uitbraaksituatie zijn €26,34. De conclusie is dan ook dat screening met chromogene media kostenbesparend is en het gebruik van moleculaire methoden extra kosten met zich meebrengt. (9)
Opgemerkt dient te worden dat eventuele positieve gevoelens en ervaringen bij gezondheidsmedewerkers door sneldiagnostiek niet zijn meegenomen. Ook is het zo dat kosteneffectiviteit van screening met PCR tijdens een MRSA-uitbraak of op een intensivecareafdeling niet is onderzocht.
Aanpassing van het Nederlandse MRSA-beleid
Om het succes van het Nederlandse search-and-destroybeleid ook in de toekomst te garanderen is een uniform, breed gedragen en praktisch uitvoerbaar MRSA-beleid nodig. Door aanpassing van het huidige MRSA-beleid aan de nieuwe ontwikkelingen is dit mogelijk. We stellen voor om, indien MRSA-sneldiagnostiek wordt verricht in aanvulling op conventionele microbiologische kweken, patiënten met een verhoogd risico op dragerschap niet meer pre-emptief te isoleren bij ziekenhuisopname. Isolatie vindt plaats als sneldiagnostiek MRSA-dragerschap aantoont en blijft gehandhaafd als de conventionele kweekresultaten dragerschap bevestigen. Het is aan de beleidsmakers voor infectiepreventie om te bepalen wat een acceptabele termijn is voordat de sneltestuitslag beschikbaar moet zijn. Is dat minder dan 24 uur dan zal sneldiagnostiek met PCR verricht moeten worden, terwijl bij een termijn van 36 uur ook chromogene media gebruikt kunnen worden voor MRSA-screening. Indien men 3 dagen ziekenhuis-opname zonder isolatiemaatregelen een acceptabele termijn vindt (in een populatie met een, voorafbeschouwd, risico op dragerschap van ongeveer 3%) dan zijn sneltesten niet nodig en kunnen de resultaten van de conventionele kweek worden afgewacht. De keuze voor een MRSA-sneltest in een bepaald ziekenhuis is afhankelijk van een aantal factoren: de lokale MRSA-epidemiologie (ziekenhuisgeassocieerde of veegerelateerde MRSA, aantal uitbraken, aantal MRSA-verdachte patiënten), organisatie van het microbiologisch laboratorium (beschikbaarheid van PCR-techniek), financiële afwegingen en persoonlijke voorkeur van betrokken artsen-microbiologen. Daarnaast is de vraag wat het ziekenhuis (of de specialist) bereid is te betalen, omdat screening met chromogene media kostenbesparend is en screening met PCR met extra kosten gepaard gaat.
Auteur
M.W.M. Wassenberg, afdelingen Interne geneeskunde en Infectieziekten en Medische Microbiologie, Universitair Medisch Centrum Utrecht
Corresponentie:
M.W.M. Wassenberg | M.W.M.Wassenberg@umcutrecht.nl
|
Costs and effects of MRSA control in Dutch hospitals
Literatuur
|