J.J. Siebenga Norovirussen zijn wereldwijd de belangrijkste veroorzakers van gastro-enteritis, ‘buikgriep’ in de volksmond. Gedurende het afgelopen decennium is er in Nederland een flinke toename geweest van het aantal gemelde uitbraken. Het onderzoek dat beschreven is in het proefschrift laat zien dat het om een daadwerkelijke toename van het aantal infecties gaat, veroorzaakt door een aantal opeenvolgende epidemische golven van nieuwe varianten van het dominante genotype. Omdat er voor norovirus geen eenvoudig kweeksysteem beschikbaar is, waren de gegevens uit de structurele uitbraaksurveillance van essentieel belang voor dit onderzoek.
Tussen 1994 en 2006 werd 68% van de gemelde norovirusuitbraken in Nederland veroorzaakt door genogroep II.4-virussen. Fylogenetische analyse van deze virussen toonde een duidelijke subclustering met een trend in de tijd. Epidemische verheffingen van norovirusuitbraken in de winters van 1996, 2002, 2004 en 2006 werden veroorzaakt door een opeenvolging van genetische varianten. Tegen deze varianten was op het moment van ontstaan nog geen immuniteit in de populatie, waardoor ze snel over de wereld konden verspreiden, en de eerder circulerende genogroep II.4-variant konden verdringen. Dit mechanisme van ogenschijnlijk stapsgewijze evolutie, veroorzaakt door populatie-immuniteit is goed bekend van influenza. Gelijktijdige analyse van epidemiologische data en sequentiedata uit surveillanceprogramma’s verspreid over de wereld liet eenzelfde patroon zien. Terugkijkend tot begin jaren negentig hebben er tot en met 2007 4 wereldwijde epidemische seizoenen plaatsgevonden, veroorzaakt door 5 verschillende varianten: GII.4-1996, GII.4-2002, GII.4-2004 en GII.4-2006a en GII.4-2006b tegelijk. Deze varianten, vernoemd naar het jaar waarin ze het eerst beschreven werden, verschillen in 8 tot 25 aminozuren in het capside-eiwit (totaal 541 aminozuren, 1,5-4,6%). Opvallend is dat de geografische verspreiding niet voor alle varianten gelijk was. De GII.4-2006a-variant werd bijvoorbeeld nauwelijks in Azië aangetroffen. Een verklaring hiervoor is niet gevonden, maar kan liggen in het feit dat er verschillen zijn in genetisch bepaalde vatbaarheid van specifieke bevolkingsgroepen, die onder meer door de histobloedgroepantigenen (HBGA) worden bepaald. Het is aangetoond dat mensen met verschillende HBGA-patronen vatbaar zijn voor verschillende norovirusgenotypen, dat geldt wellicht ook op subgenotypeniveau voor de varianten.
Om aan te tonen dat het toenemende aantal rapportages van uitbraken een werkelijke stijging in het voorkomen van norovirus laat zien, werden in silico Bayesiaanse Markov chain Monte Carlo (MCMC) coalescentieanalyses toegepast op een dataset van 1383 partiële polymerasesequenties. MCMC-coalescentieanalyses zijn algoritmes voor sampling uit waarschijnlijkheidsverdelingen, met de gewenste situatie als evenwichtspunt. Evolutionaire hypotheses kunnen hiermee worden getest door gewicht toe te kennen aan een (groot) aantal mogelijke fylogeniën dat proportioneel is aan de waarschijnlijkheid van iedere fylogenie. De bestudeerde GII.4-stammen evolueerden met een snelheid van 4.3 tot 9 x 10-3 mutaties per site per jaar. De meest recente voorouder van de in de studie opgenomen stammen circuleerde in de vroege 80-er jaren van de vorige eeuw. Dit betekent niet dat er voor die tijd geen GII.4-virussen circuleerden, integendeel, die zijn beschreven in de literatuur. Het illustreert wel mooi dat er in de evolutie van de norovirussen herhaaldelijk zuiverende bottlenecks optreden. Op basis van de resultaten van moleculaire adaptatieanalyses formuleerden we een set aminozuren die samen een vingerafdruk van mogelijke varianttransitie vormen.
Het gegeven, dat het aantal norovirusinfecties is toegenomen krijgt, in het licht van de andere studies die in het proefschrift zijn opgenomen, een extra lading. Uitbraken gebeuren veelal op plaatsen waar mensen dicht op elkaar leven, zoals in ziekenhuizen en verpleeghuizen, waar juist de mensen verblijven die risico hebben op een ernstig ziekteverloop. In deze kwetsbare groep mensen ontstaan, vaker dan gedacht, langdurige of zelfs chronische infecties, die een fatale afloop kunnen hebben en een bron van nieuwe infecties vormen. Een retrospectieve studie liet zien dat ten minste 8% van noroviruspositieve patiënten in een ziekenhuis langdurig geïnfecteerd raakte, waarbij ook langdurig symptomen aanwezig waren, en reeds zwakke patiënten ten dele aan de gevolgen van de norovirusinfectie overleden. De capside-eiwitten van de virussen in deze patiënten evolueerden over tijd. De snelheid waarmee mutaties in de virussen accumuleerden was niet bij alle patiënten gelijk; in de patiënt met de meest ernstige immuunstoornis accumuleerden maar weinig mutaties. In een andere patiënt werden in het capside-eiwit (541 aminozuren) 11 aminozuurmutaties gevonden in een 119-dagen durende periode, in of rond antigene sites, een sterke aanwijzing voor immuungedreven selectie. Hoewel het aantal patiënten in de studie te laag is om conclusies te kunnen trekken is het interessant om op te merken dat met name bij patiënten met lage antilichaamniveaus in het bloed sprake was van lage mutatieaccumulatiesnelheden. Ondanks het feit dat er onverwacht veel langdurige infecties werden gevonden, en de grote hoeveelheden mutaties in de virussen in deze patiënten, lijkt het niet aannemelijk dat deze patiënten de bron zijn van nieuwe varianten. Het aantal infecties in de gezonde populatie is vele malen groter en in deze populatie is de mutatiesnelheid per tijdseenheid hoger.
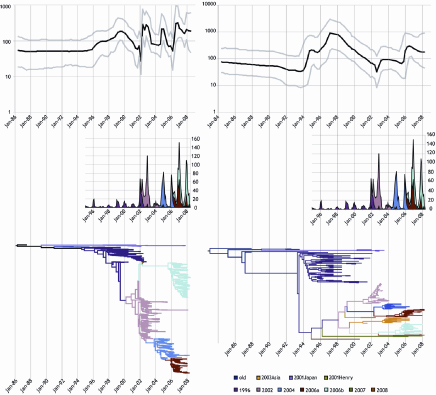
Figuur 1. Fylodynamica van de GII.4-norovirussen.
Het linker paneel (A,B,C) toont de analyses van de polymerasedataset (1383 taxa, 247 nucleotiden), het rechter paneel (D,E,F) van de capsidedataset (194 taxa, 1623 nucleotiden). A) Bayesiaanse Skyline Plot (BSP) van GII.4-norovirus partiele polymerasesequenties, toont de relatieve genetische diversiteit, een maat voor het aantal effectieve infecties van circulerende GII.4-norovirussen door de tijd. De zwarte lijn is de median posterior value, de grijze lijnen vormen de grenzen van het 95% hoogste waarschijnlijkheidsdichtheid (Highest Probability Density, HPD). De Y-as toont de waarde van Neτ op een logaritmische schaal. Neτ is het product van populatiegrootte en generatietijd, en is een maat voor genetische diversiteit. Deze maat is niet direct in een concreet bevolkings- of infectiesgerelateerd getal te vertalen. B en E) Surveillancedata van norovirus GII.4-stammen, in Nederlandse en Europese uitbraken gedetecteerd. Opgenomen ter vergelijking met de epidemische verheffingen. De verschillende GII.4-varianten zijn weergegeven in verschillende kleuren zodat de opeenvolging van varianten in de tijd duidelijk is. De zelfde kleuren zijn ook gebruikt in D en F, de kleuren legenda is onder F weergegeven. C) Maximum Clade Credibility (MCC)- boom van norovirus GII.4 partiële polymerasedataset. De MCC- boom toont een schatting van de posteriorverdeling van bomentopologieën en branchlengtes en geeft uit het resultaat van een Bayesiaanse iteratie (dit resultaat is een grote verzameling mogelijk topologien voor de fylogenetische boom met hun waarschijnlijkheid) de boom weer met de hoogste waarschijnlijkheid. De boom is geschaald in tijdseenheden, met de tips vastgezet op detectietijd van de stam. D) BSP van de GII.4-noroviruscapsidedataset. F) MCC-boom van de GII.4-noroviruscapsidedataset.
Tot slot konden we door trendanalyses van gegevens uit de medische registratiesystemen en de database van norovirusuitbraken concluderen dat onder de oudere bevolkingsgroepen norovirusactiviteit significant geassocieerd is met toenemend huisartsbezoek, ziekenhuisopnames én sterfte.
Het onderzoek beschreven in dit proefschrift draagt bij aan de kennis over de moleculaire epidemiologie van norovirus. De resultaten kunnen bijdragen aan de gerichte bestrijding van norovirusinfecties, het verminderen van de impact ervan op de bevolking en de omvang van toekomstige uitbraken en epidemieën. Surveillance blijft belangrijk om te monitoren welke genotypen en varianten circuleren en om hypotheses voor verder onderzoek te genereren.
Auteur
J.J. Siebenga
Correspondentie:
J. Siebenga | joukjes@yahoo.co.uk
A Study of Norovirus Molecular Epidemiology: impact, prevalence, diversity and genetic adaptation.
J.J. Siebenga
RIVM-Centrum Infectieziektebestrijding, Erasmus Universiteit/Medisch Centrum
Promotor: prof (professor). dr. (doctor) M.P.G. Koopmans
ISBN: 978-90-6464-415-3
pdf: http://repub.eur.nl/res/pub/21345/
A