Antimicrobiële resistentie vormt een steeds belangrijkere dreiging voor de gezondheidszorg wereldwijd. (1) Het gebruik van antibiotica in mens en dier is een belangrijke risicofactor voor deze toenemende resistentie. (2) Gezien de enorme groei van internationaal toerisme, van 25 miljoen reizigers in 1950 naar 1.133 miljard reizigers in 2014, (3) levert internationaal reizen mogelijk ook een substantiële bijdrage aan de toename van resistentie. Immers resistente bacteriën of mobiele genetische elementen die resistentiegenen bevatten kunnen zich zodoende makkelijk verspreiden tussen regio’s. (4) Een belangrijk deel van de antimicrobiële resistentiegenen is gelegen op plasmiden en codeert onder andere voor extended-spectrum betalactamases (ESBLs, zoals TEM, SHV en CTX (Cerebrotendineuze Xanthomatose)-M) en carbapenemases. Dit zijn enzymen die resistentie veroorzaken tegen de meeste betalactam-antibiotica. (2,4) Bovendien zijn ESBL (Extended spectrum beta-lactamases)-producerende Enterobacteriaceae (ESBL-E) en carbapenemaseproducerende Enterobacteriaceae (CPE) vaak resistent tegen meerdere andere antibioticaklassen, waardoor weinig tot geen effectieve antimicrobiële middelen beschikbaar meer zijn voor de preventie en behandeling van infecties. (4,5)
ib november 2017
Auteurs: M. S. Arcilla, J. M. van Hattem, M. R. Haverkate, M. C.J. Bootsma, P. J.J. van Genderen, A. Goorhuis, M. P. Grobusch, A. M. Oude Lashof, N. Molhoek, C. Schultsz, E. E. Stobberingh, H. A. Verbrugh, M.D. de Jong, D. C. Melles, J. Penders
Infectieziekten Bulletin, jaargang 28, nummer 9, november 2017
Eerdere studies hebben hoge acquisitiepercentages van ESBL-E (ESBL-producerende Enterobacteriaceae) en sporadische acquisitie van CPE (Carbapenemase-producerende Enterobacterales ) onder internationale reizigers gerapporteerd. (6-10) Echter, data over ESBL-E-kolonisatie en transmissie binnen huishoudens na reizen en risicofactoren voor de kolonisatieduur zijn beperkt. Zulke data zijn nodig om vast te stellen wat het risico van introductie en verspreiding van antimicrobiële resistentie door reizigers voor de volksgezondheid is, en wat de mogelijke noodzaak en maatregelen zijn om deze risico’s te monitoren of te beperken. Het identificeren van individuen die een risico hebben om ESBL-E- drager te zijn, maakt het mogelijk om tot doelmatige maatregelen te komen om verdere introductie en verspreiding van ESBL-E of CPE te voorkomen. Bovendien leidt het aanpassen van de empirische antimicrobiële therapie in individuen die een risico hebben op ESBL-E-dragerschap tot optimale klinische zorg. In deze studie hebben wij de acquisitie van ESBL-E tijdens internationaal reizen, de risicofactoren voor deze acquisitie, de duur van kolonisatie en de transmissie naar huisgenoten onderzocht.
Methoden
Studieopzet en deelnemers
De studieopzet en methoden zijn elders uitgebreid beschreven. (11) In een multicenter, longitudinale prospectieve cohortstudie hebben we reizigers vanaf 1-3 weken voor de reis tot 12 maanden na terugkomst gevolgd. Om transmissie binnen het huishouden te bestuderen hebben we ook niet-reizende huisgenoten in dezelfde periode gevolgd.
Geschikte deelnemers waren volwassenen (leeftijd ≥ 18 jaar) die van plan waren om minimaal 1 week tot maximaal 3 maanden te reizen. Ze werden geworven bij de Travel Clinic Havenziekenhuis (Rotterdam), het Tropencentrum AMC (Academisch Medisch Centrum Amsterdam ) (Amsterdam), en de Ease Travel Clinic &Health support (Zuid-Limburg) van november 2012 tot november 2013. Alle deelnemers hebben een toestemmingsformulier ondertekend.
Procedures
Deelnemers kregen een ontlastingsafnamepakket en werden geïnstrueerd om zelf met een wattenstokje een fecesmonster af te nemen, voor, direct na en 1 maand na de reis. Indien een van deze ontlastingsmonsters een ESBL-E bevatte, werden de reiziger en zijn of haar huisgenoten gevraagd om ook 3, 6 en 12 maanden na de reis ontlastingsmonsters af te nemen. Indien geen van de monsters positief was voor ESBL-E werden er geen extra monsters verzameld. Vragenlijsten werden op alle tijdsmomenten verzameld om informatie te verzamelen over mogelijke risicofactoren voor ESBL-E-acquisitie en kolonisatieduur, demografische gegevens, co-morbiditeit, en gedrag voor, tijdens en na het reizen. Monsters werden direct na ontvangst verwerkt. Ze werden geïnoculeerd in een trypticase sojabouillon, gesupplementeerd met vancomycine (50 mg/L (milligram per liter)) om te selecteren voor Enterobacteriaceae. De bouillon werd vervolgens gekweekt op een chromID ESBL (Extended spectrum beta-lactamases)-agarplaat (bioMérieux, Marcy l’Etoile, Frankrijk). Alle morfologisch verschillende kolonies werden geïdentificeerd tot op speciesniveau met matrix-assisted laser desorption/ionisation time-of-flight mass spectrometrie (Bruker Microflex LT, Bruker, London, UK (United Kingdom)). De minimaal remmende concentratie van verschillende antibiotica werd bepaald van alle Enterobacteriaceae met de Vitek (bioMérieux). ESBL-productie werd fenotypisch geconfirmeerd door de combinatie disk-diffusiemethode volgens de huidige nationale richtlijnen. (12)
Alle fenotypisch geconfirmeerde ESBL-E-isolaten verworven tijdens de reis, werden gescreend op de aanwezigheid van ESBL-genen met microarray zoals eerder beschreven. De aanwezigheid van ESBL-genen werd geconfirmeerd door PCR (polymerase chain reaction) met primers specifiek voor CTX (Cerebrotendineuze Xanthomatose)-M-enzymgroepen 1,2,8,9 en 25. Verdere karakterisering door sequentieanalyse werd verricht voor de meest prevalente CTX-M- groepen, 1 en 9. PCR-confirmatie- en sequentieanalyse van genen voor TEM en SHV ESBLs (Extended Spectrum Beta-Lactamases) werden beperkt tot isolaten die negatief bleken voor alle CTX-M-genen op basis van de microarray. Een algemene CTX-M enzymgroepen PCR werd verricht indien geen ESBL-genen werden gedetecteerd door de microarray. Wanneer deze groepen PCR-positief was, volgde bevestiging door een specifieke PCR en sequentieanalyse voor de verschillende CTX-M-groepen. Sequenties werden vergeleken met data uit de NCBI (National Center for Biotechnology Information) GenBank en Lahey databanken.
Acquisitie werd gedefinieerd als afwezigheid van ESBL-E in ontlastingsmonsters voor de reis en aanwezigheid van fenotypisch geconfirmeerde ESBL-E in monsters verkregen direct na de reis. Duur van dragerschap werd gedefinieerd als het laatste positieve monster welke een ESBL van dezelfde groep (TEM, SHV, of CTX-M-groepen 1, 2, 8, 9 of 25 of een combinatie) bevatte als het monster afgenomen direct na de reis. Deelnemers met opeenvolgende monsters positief voor ESBL-E werden geclassificeerd als persisterende dragers en deelnemers met ESBL-E- positieve monsters afgewisseld met tenminste 1 negatief monster werden geclassificeerd als intermitterende dragers.
Statistische analyse
De cumulatieve incidentie, de incidentie per 100 persoonsdagen van reizen en de bijbehorende 95% betrouwbaarheidsintervallen (BI) voor ESBL-E-acquisitie, werden berekend voor elke subregio en land van bestemming. De incidentie per 100 persoonsdagen van reizen werd berekend met de methode maximum likelihood die was gebaseerd op een constante acquisitiekans met rechtsgecensureerde en intervalgecensureerde data.
Risicofactoren voor ESBL-E-acquisitie werden onderzocht met logistische regressiemodellen op basis van de methode van Bursac en collega’s (13) en geanalyseerd met SPSS (Statisch computerprogramma) Statistics (versie 21.0). Resultaten zijn gepresenteerd als odds ratio’s (ORs) en 95% BIs. Een afzonderlijke analyse werd uitgevoerd voor de subregio’s Zuidoost-Azië, Zuid-Azië en Oost-Afrika, omdat diverse aan dieet gerelateerde factoren (consumptie van kip, barbecue vlees of varkensvlees) een statistische interactie lieten zien met specifieke subregio’s. Tijd tot dekolonisatie werd vastgesteld met een Kaplan-Meier-survivalanalyse met rechtscensurering van deelnemers van wie het laatst verzamelde monster ESBL-E-positief was. Univariabele en multivariabele Cox’s regressieanalyse werden verricht om te identificeren welke risicofactoren geassocieerd waren met dekolonisatie. Deze resultaten zijn gepresenteerd als hazard ratio’s (HRs) en 95% BIs (HRs <1.00 geven aan dat er een verminderd risico is op dekolonisatie, oftewel een verhoogd risico op verlengde duur van dragerschap).
Om de transmissiekans van ESBL-E binnen huishoudens te berekenen, is een Markovmodel ontwikkeld. Dit model was gebaseerd op fenotypisch bevestigde ESBL-E en alleen data van huishoudens met een maximale grootte van 5 personen zijn geïncludeerd, wat 98% van de huishoudens omvatte. Het model hield rekening met fout-negatieve resultaten, missende kweekresultaten en de niet-geobserveerde tijden waarop kolonisatie is ontstaan. Het model werkte als volgt: ESBL-E-positieve personen (zowel reizigers als niet-reizende huisgenoten) konden ESBL-E overdragen naar hun huisgenoten met snelheid β. Transmissie van ESBL-E vanuit andere bronnen was opgenomen in de achtergrondtransmissieparameter α. Verlies van kolonisatie met ESBL-E gebeurde met snelheid γ. Negatieve kweken konden in het model fout-negatief zijn en daarmee de schatting van de sensitiviteit φ beïnvloeden. De specificiteit van de kweken werd verondersteld 100% te zijn. De transmissiekans van ESBL-E van een ESBL-E-positieve persoon naar een ESBL-E-negatieve persoon, gegeven het feit dat de ESBL-E-negatieve persoon geen ESBL-E opliep via een andere route, kon berekend worden als β/(β+γ). De verschillende parameters van het model werden gelijktijdig geschat met een maximum-likelihoodmethode in Mathematica versie 9.0.
Resultaten
2737 reizigers werden gescreend voor geschiktheid, van wie 2001 geïncludeerd zijn in de studie. De mediane leeftijd was 50,5 jaar (IQR 32,8-60,7) en de meerderheid had een goede gezondheid (tabel 1). 49 reizigers raakten lost to follow-up.
Tabel 1. Algemene karakteristieken van reizigers en niet-reizende huisgenoten
|
|
Reizigers (n=2001)* |
Niet-reizende huisgenoten (n=215)† |
|
Geslacht |
||
|
Man |
920 (46,0%) |
80 (37,2%) |
|
Vrouw |
1081 (54,0%) |
135 (62,8%) |
|
Leeftijd in jaren (mediaan, IQR) |
50,5 (32,8-60,7) |
46,9 (25,7-55,8) |
|
Opleidingsniveau |
||
|
Geen opleiding, lager onderwijs of lager beroepsonderwijs |
243 (12,4%) |
78 (36,4%) |
|
Middelbaar algemeen onderwijs |
280 (14,2%) |
37 (17,3%) |
|
Middelbaar beroepsonderwijs of hoger algemeen onderwijs |
200 (10,2%) |
45 (21,0%) |
|
Hoger beroepsonderwijs |
642 (32,7%) |
53 (24,7%) |
|
Wetenschappelijk onderwijs |
595 (30,3%) |
38 (17,8%) |
|
Antibioticagebruik in afgelopen 3 maanden |
||
|
Nee |
1760 (90,1%) |
189 (88,3%) |
|
Ja |
194 (9,9%) |
25 (11,7%) |
|
Reizen in het afgelopen jaar |
||
|
Geen reis |
185 (9,5%) |
27 (12,6%) |
|
Reizen binnen Europa |
915 (46,9%) |
124 (57,7%) |
|
Reizen buiten Europa |
852 (43,6%) |
64 (29,8%) |
|
Chronische ziekte‡ |
||
|
Nee |
1500 (77,2%) |
173 (82,0%) |
|
Ja |
443 (22,8%) |
38 (18,0%) |
|
Chronische darmziekte‡ |
||
|
Nee |
1912 (97,4%) |
212 (99,1%) |
|
Ja |
51 (2,6%) |
2 (0,9%) |
|
Continenten bezocht tijdens indexreis§ |
||
|
Azië |
1016 (50,8%) |
|
|
Afrika |
633 (31,6%) |
|
|
Amerika |
326 (16,3%) |
|
|
Europa |
21 (1,0%) |
|
|
Oceanië |
5 (0,2%) |
|
|
Duur van indexreis (dagen) |
20 (15,0-25,0) |
|
|
Reden van index reis |
||
|
Vakantie |
1655 (84,2%) |
|
|
Werk of stage |
161 (8,2%) |
|
|
Familiebezoek |
82 (4,2%) |
|
|
Andere reden |
66 (3,4%) |
Data zijn in aantallen (%) of mediaan (IQR=interkwartiele bereik)
* Sommige aantallen tellen niet op tot 2001 vanwege missende data
† Sommige aantallen tellen niet op tot 215 vanwege missende data
‡ Zelfgerapporteerd door reiziger of niet reizende huisgenoot
§ Indien reiziger meerdere continenten heeft bezocht, wordt alleen het voornaamste continent gepresenteerd in deze tabel
De voornaamste reden voor reizen was toerisme (1655 (84,2%) van 1965 reizigers) en de mediane reisduur was 20 dagen (IQR 15,0-25,0; tabel 1). De meest bezochte subregio’s waren Zuidoost-Azië (n=650), Oost-Afrika (n=287), Zuid-Amerika (n=228), en Zuid-Azië (n=217). 122 (6,1%) van de 2001 reizigers waren drager van ESBL-E voor de reis, waardoor nog 1879 reizigers een risico hadden op ESBL-E-acquisitie. Van deze laatstgenoemde groep stuurden 1847 (98.3%) reizigers een ontlastingsmonster in direct na de reis. Hiervan bleken 633 reizigers tenminste 1 ESBL-E te hebben opgelopen tijdens de reis (tabel 2), wat overeenkomt met een acquisitiepercentage van 34,3% (95% CI (Canadian Intense) 32,1-36,5). Bij deze 633 reizigers werden 859 morfologisch verschillende ESBL-E- stammen geïsoleerd (759 Escherichia coli, 67 Klebsiella pneumoniae, en 33 andere species). CTX-M-15 was het meest frequent verworven ESBL-gen (338/633 reizigers (53,4%)).
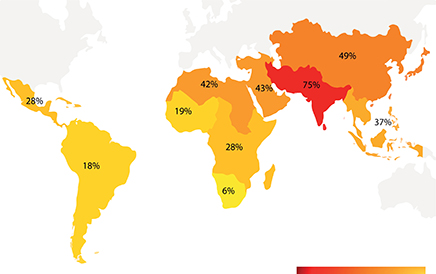
ESBL-E werden het meest frequent verworven na een reis naar Zuid-Azië (75,1%, 95% CI 68,4-80,9), gevolgd door Centraal,- en Oost-Azië (48,8%, 38,4-59,3; tabel 2, figuur 1). De acquisitiepercentages varieerden echter ook sterk tussen landen binnen eenzelfde subregio. Onder de 22 meest frequent bezochte landen, was de acquisitie het hoogst in India (88,6%, 95% CI 79,8-93,9) en het laagste in Suriname (3,6%, 1,0-12,1). Ook reizigers naar Oost-Afrikaanse landen, zoals Oeganda (44,4%, 27,6-62,7), liepen regelmatig een ESBL-E op.
Tabel 2. Incidentie proportie en incidentie per 100 persoonsdagen van reizen voor ESBL-E-acquisitie in Nederlandse reizigers, per subregio
|
Reisbestemming |
Reizigers (n=1847)* |
Reizigers met ESBL-E acquisitie (n=633)† |
ESBL-E incidentie proportie (95% CI)‡ |
Aantal reisdagen |
Gemiddelde (SD) duur van reis in dagen |
ESBL-E-incidentie per 100 persoons- dagen van reizen (95% CI)§ |
|---|---|---|---|---|---|---|
|
Zuid-Azië |
181 |
136 |
75,1 (68,4-80,9) |
3727 |
20,6 (11,0) |
7,2 (5,9-8,6) |
|
Centraal- en Oost-Azië |
84 |
41 |
48,8 (38,4-59,3) |
1712 |
20,4 (10,8) |
3,5 (2,5-4,7) |
|
West-Azië |
28 |
12 |
42,9 (26,5-60,9) |
305 |
10,9 (7,5) |
5,8 (3,0-9,9) |
|
Noord-Afrika |
81 |
34 |
42,0 (31,8-52,9) |
981 |
12,1 (5,7) |
4,5 (3,1-6,2) |
|
Zuidoost-Azië |
540 |
200 |
37,0 (33,1-41,2) |
12493 |
23,1 (11,6) |
2,1 (1,8-2,4) |
|
De Caraïben en Midden-Amerika |
86 |
24 |
27,9 (19,5-38,2) |
1653 |
19,2 (12,4) |
1,7 (1,1-2,5) |
|
Midden en Oost-Afrika |
205 |
57 |
27,8 (22,1-34,3) |
4060 |
19,8 (14,3) |
1,6 (1,2-2,1) |
|
West-Afrika |
106 |
20 |
18,9 (12,6-27,4) |
1638 |
15,5 (11,1) |
1,4 (0,8-2,0) |
|
Zuid-Amerika |
180 |
33 |
18,3 (13,4-24,6) |
4778 |
26,5 (14,7) |
0,8 (0,5-1,1) |
|
Zuid-Afrika |
116 |
7 |
6,0 (2,5-12,0) |
2522 |
21,7 (8,6) |
0,3 (0,1-0,6) |
|
Noord-Amerika, Europa, en Oceanië |
17 |
1 |
5,9 (1,1-27,0) |
292 |
17,2 (11,3) |
0,4 (0-1,6) |
ESBL-E= extended-spectrum betalactamaseproducerende Enterobacteriaceae
* Aantallen tellen niet op tot 1847 omdat 221 reizigers meer dan een subregio hebben bezocht (66 met ESBL-E-acquisitie) en reisbestemming mist voor 2 reizigers
† Aantallen tellen niet op tot 633 omdat 66 reizigers met ESBL-E-acquisitie meer dan een subregio hebben bezocht en reisbestemming mist voor 2 reizigers
‡ Gebasseerd op binomiale distributie (Wilson score interval)
§ Berekend met maximum likelihood estimation gebasseerd op een constante acquisitiesnelheid met rechtsgecensureerde en intervalgecensureerde data
In de multivariabele logistische regressieanalyse bleek antibioticagebruik tijdens de reis de sterkste onafhankelijke risicofactor voor ESBL-E-acquisitie (Tabel 3). Om het effect van verschillende antibioticaklassen vast te stellen, hebben we vervolgens de variabele ‘antibioticagebruik tijdens de reis (nee versus ja)’ vervangen door de variabele ‘antibioticaklasse’ (geen antibiotica versus betalactam-antibiotica, of quinolonen of andere antibioticaklasse). Gebruik van quinolonen was het sterkst geassocieerd met ESBL-acquisitie (gecorrigeerde OR 6,0, 95% CI 2,9-12,4), terwijl associaties voor gebruik van betalactam-antibiotica (2,2, 0,95-5,14) of andere antibiotica (1,7, 0,59-2,35) niet significant waren. Er was een sterke associatie tussen ESBL-E-acquisitie en diarree tijdens de reis, met name reizigersdiarree die aanhield na terugkomst van de reis (Tabel 3). Ook was er een verhoogd risico bij het eten van voedsel bij straatverkopers. Dit risico werd hoger wanneer dit dagelijks gebeurde (Tabel 3). Zelfgerapporteerde pre-existente chronische darmziekte was een andere opvallende risicofactor voor ESBL-ESBL-E-acquisitie (Tabel 3).
Figuur 1. Percentage reizigers dat ESBL-E opliep per subregio (volgens indeling van de Verenigde Naties)
In de subgroepanalyse voor 3 van de bezochte subregio’s, waren het eten van rauwe groenten en gebruik van antibiotica risicofactoren voor ESBL-E-acquisitie in Zuidoost-Azië. In Zuid-Azië was de sterkste risicofactor contact met weeskinderen en een dagelijkse maaltijd in een hostel of guesthouse. In Oost-Afrika was de sterkste associatie dagelijks bezoek aan de lokale markten en een verblijf in rurale gebieden.
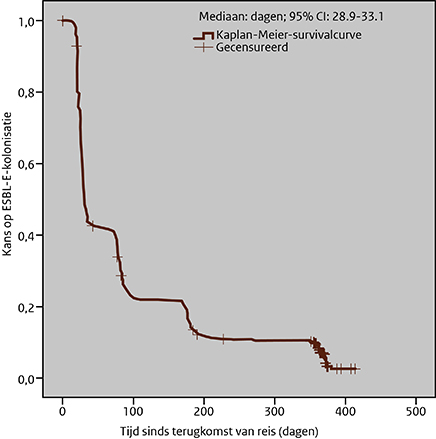
Een verlengde duur van ESBL-E-dragerschap (persisterend en intermitterend) na acquisitie werd gezien in 42,9%, 25,1%, 14,3% en 11,3% van de reizigers op respectievelijk 1, 3, 6, en 12 maanden na de reis. De meerderheid van de reizigers waren continu gekoloniseerd. De mediane duur van dragerschap na de reis was 30,0 dagen (95% CI 28,9-33,1, figuur 2). ESBL-producerende K. pneumoniae en reizen naar West-Azië waren geassocieerd met de kortste tijd tot dekolonisatie. Reizigers die een CTX-M-groep 9 ESBL-E hadden verworven, hadden een significant langere duur van dragerschap vergeleken met reizigers die een CTX-M-groep 1 ESBL-E hadden verworven.
Tabel 3. Risicofactoren voor ESBL-E-acquisitie onder reizigers in het finale aangepaste logistische regressiemodel
|
Reizigers met risico op ESBL-E acquisitie (n=1847)* |
Reizigers met ESBL-E acquisitie (n=633)† |
Odds ratio (95% CI)‡ |
p-waarde |
Adjusted Odds ratio (95% CI)§ |
p-waarde |
|
|---|---|---|---|---|---|---|
|
Pre-existente chronische darmziekte |
||||||
|
Nee |
1793 (97,3%) |
606 (33,8%) |
1,00 |
1,00 |
|
|
|
Ja |
50 (2,7%) |
24 (48,0%) |
2,34 (1,26-4,34) |
0,007 |
2,10 (1,13-3,90) |
0,019 |
|
Strand vakantie |
||||||
|
Nee |
1404 (76,1%) |
504 (35,9%) |
1,00 |
1,00 |
|
|
|
Ja |
441 (23,9%) |
127 (28,8%) |
0,72 (0,55-0,93) |
0,010 |
0,73 (0,56-0,95) |
0,021 |
|
Reizigersdiarree¶ |
||||||
|
Geen |
1085 (60,1%) |
329 (30,3%) |
1,00 |
1,00 |
0,001 |
|
|
Tijdens reis |
593 (32,8%) |
235 (39,6%) |
1,56 (1,24-1,96) |
<0,001 |
1,42 (1,12-1,80) |
0,003 |
|
Direct na de reis |
41 (2,3%) |
14 (34,1%) |
1,19 (0,58-2,44) |
0,640 |
1,3 (0,63-2,68) |
0,477 |
|
Tijdens en direct na de reis |
87 (4,8%) |
44 (50,6%) |
2,42 (1,50-3,91) |
<0,001 |
2,31 (1,42-3,76) |
0,001 |
|
Antibiotica tijdens de reis∫? |
||||||
|
Nee |
1697 (92,8%) |
553 (32,6%) |
1,00 |
1,00 |
|
|
|
Ja |
132 (7,2%) |
73 (55,3%) |
2,65 (1,80-3,91) |
<0,001 |
2,69 (1,79-4,05) |
<0,001 |
|
Bijwonen van grote (religieuze) bijeenkomst |
||||||
|
Nee |
1744 (94,6%) |
595 (34,1%) |
1,00 |
1,00 |
|
|
|
Ja |
100 (5,4%) |
36 (36,0%) |
0,56 (0,34-0,92) |
0,020 |
0,57 (0,34-0,94) |
0,028 |
|
Dagelijkse handhygiëne voor maaltijden |
||||||
|
Geen |
782 (42,4%) |
265 (33,9%) |
1,00 |
1,00 |
0,112 |
|
|
Schoonmaken met alcohol |
161 (8,7%) |
69 (42,9%) |
1,03 (0,71-1,51) |
0,870 |
0,97 (0,66-1,44) |
0,885 |
|
Schoonmaken met zeep |
666 (36,1%) |
200 (30,0%) |
0,82 (0,64-1,04) |
0,100 |
0,77 (0,60-0,99) |
0,044 |
|
Schoonmaken met alcohol en zeep |
235 (12,7%) |
97 (41,3%) |
1,03 (0,74-1,44) |
0,860 |
1,12 (0,79-1,59) |
0,518 |
|
Maaltijd bij straat kraampjes tijdens de reis |
||||||
|
Nooit |
1248 (67,7%) |
386 (30,9%) |
1,00 |
1,00 |
0,014 |
|
|
Regelmatig |
513 (27,8%) |
205 (40,0%) |
1,37 (1,08-1,73) |
0,010 |
1,33 (1,04-1,71) |
0,022 |
|
Dagelijks |
83 (4,5%) |
40 (48,2%) |
2,09 (1,30-3,38) |
0,003 |
1,78 (1,07-2,95) |
0,025 |
ESBL-E= extended-spectrum betalactamaseproducerende Enterobacteriaceae
Aantallen tellen niet op tot 1847 omdat 221 reizigers meer dan een subregio hebben bezocht (66 met ESBL-E acquisitie) en reisbestemming mist voor 2 reizigers
† Aantallen tellen niet op tot 633 omdat 66 reizigers met ESBL-E-acquisitie meer dan een subregio hebben bezocht en reisbestemming mist voor 2 reizigers
‡ Gebasseerd op binomiale distributie (Wilson score interval)
§ Berekend met maximum likelihood estimation methode gebasseerd op een constante acquisitiesnelheid met rechtsgecensureerde en intervalgecensureerde data
¶ Gedefinieerd als ≥ 3 maal waterdunne of brijige ontlasting binnen 24 uur, met of zonder begeleidende symptomen
∫ Meest frequent gebruik voor behandeling van gastro-enteritis (41 [31,1%] van 132 reizigers), van wie 17 (41,5%) antibiotica gebruikte zonder het consulteren van een arts
Van de 215 niet-reizende huisgenoten in deze studie, waren er 63 huisgenoten die ESBL-E-negatief waren op moment van inclusie en die samenwoonden met deelnemers die een ESBL-E hadden verworven tijdens de reis. Daarnaast waren er 105 reizigers ESBL-E-negatief direct na de reis terwijl een andere reiziger binnen hetzelfde huishouden wel een ESBL-E hadden verworven tijdens de reis. In totaal waren er dus 168 huisgenoten (in 152 huishoudens) at risk voor ESBL-E-transmissie. Transmissie binnen huishoudens werd gezien in 13 (7.7%) van deze 168 huisgenoten (10 medereizigers en 3 niet-reizende huisgenoten), doordat een of meer van hun follow-upisolaten positief was voor dezelfde ESBL-groep (TEM, SHV, CTX-M groep 1,2,8,9 of 25) als de indexreiziger.
We hebben vervolgens 3330 personen uit 1542 huishoudens geïncludeerd om de transmissiekans van ESBL-E te bepalen na introductie in een huishouden. 381 huishoudens bestonden uit 1 persoon, 774 uit 2 personen, 187 uit 3, 160 uit 4 en 40 uit 5. Transmissie van persoon-naar-persoon trad op met een geschatte snelheid van 0,0013 (95% BI 0,0005-0,0024) per gekoloniseerd persoon per dag. De achtergrondtransmissie gebeurde met een snelheid van 0,00073 (0,00054-0,0009) per dag. De snelheid van ESBL-E-dekolonisatie werd geschat op 0,010 (0,0092-0,011) per dag. De sensitiviteit van het screeningsproces werd door het model geschat op 90% (86-93). De hieruit berekende transmissiekans van ESBL-E van een ESBL-E-positief persoon naar een ESBL-EE-negatief persoon bleek 12% (5-18).
Figuur 2. Kaplan-Meiercurve van tijd tot dekolonisatie van ESBL-E in reizigers
Discussie
De resultaten van dit onderzoek geven aan dat het risico op ESBL-E-acquisitie tijdens reizen naar met name Azië en Noord-Afrika hoog is. 11,3% van de reizigers die een ESBL-E hadden verworven waren 12 maanden na terugkomst nog steeds gekoloniseerd. De geschatte kans op transmissie van ESBL-E binnen huishoudens was 12%. Naast reisbestemming bleken antibioticagebruik, reizigersdiarree (vooral wanneer dit aanhield bij terugkomst), en pre-existente chronische darmziekten belangrijke risicofactoren voor de acquisitie van ESBL-E gedurende de reis.
De frequentie van ESBL-import door reizigers is een reden tot zorg. 75,1% van de reizigers naar Zuid-Azië en 40-50% van reizigers naar Centraal, Oost- of West-Azië, en Noord-Afrika verwierven een ESBL-E tijdens de reis. Bovendien was de ESBL-E-acquisitie aanzienlijk in sommige landen binnen Centraal- en Oost-Afrika, met name Oeganda (44.4%). Tot nu toe waren data over acquisitie onder reizigers naar landen in Centraal- en Oost-Afrika zeer beperkt. Ook hebben we eerder acquisitie van carbapenemases en plasmidegemedieerde mcr-1 colistineresistentiegenen aangetoond in respectievelijk 5 en 6 reizigers binnen deze studiepopulatie.(14,15)
Slechts 2 van de 6 studies die eerder een multivariabele risicofactoranalyse hebben uitgevoerd, identificeerde antibioticagebruik en reizigersdiarree als significante risicofactoren voor ESBL-E-acquisitie onder reizigers. (6-8) Dit kan waarschijnlijk worden verklaard door de te kleine aantallen deelnemers in deze eerdere studies om uitgebreide risicofactoranalyses uit te voeren. Een zelfgerapporteerde pre-existente chronische darmziekte (voornamelijk inflammatoire darmziekten, prikkelbaredarmsyndroom en coeliakie) was een risicofactor voor ESBL-E-acquisitie in onze studie die nog niet eerder beschreven was. Van antibioticagebruik, reizigersdiarree en chronische darmziekten is bekend dat deze geassocieerd zijn met een verstoring van de darmmicrobiota. (16-18) Waarschijnlijk is de verminderde kolonisatieresistentie als gevolg van microbiële dysbiose het onderliggende biologische mechanisme waardoor de reizigers ontvankelijk waren voor ESBL-E-acquisitie. Antimicrobiële middelen beïnvloeden de darmmicrobiota, hetgeen zich voornamelijk uit door een vermindering van kolonisatieresistentie. Hierdoor hebben pathogene of resistente bacteriën de mogelijkheid om uit te groeien. In deze studie vonden we dat naast reisbestemming, antibioticagebruik, met name gebruik van quinolonen zoals ciprofloxacine tijdens de reis, de sterkste risicofactor was voor ESBL-E-acquisitie. Een grote verstoring in de menselijke microbiota is gerapporteerd na behandeling met ciprofloxacine. (16,20) Hoewel het effect van amoxicilline op de samenstelling van darmmicrobiota beperkt is, wordt ook voor amoxicilline een toename in de relatieve hoeveelheid van resistente Enterobacteriaceae beschreven. (16,19) Antibiotica werden door de reizigers binnen onze studie het meest gebruikt voor de behandeling van gastro-enteritis, hetgeen consistent is met eerdere studies. (21) Import van ESBL-E door reizigers zou kunnen worden verminderd door reizigers vóór de reis te adviseren terughoudend te zijn met antibiotica wanneer het gaat om zelflimiterende infecties. Kantele en collega’s (22) lieten bijvoorbeeld zien dat gebruik van uitsluitend loperamide voor de behandeling van milde reizigersdiarree niet geassocieerd was met een verhoogd risico op ESBL-E-kolonisatie.
De hogere ESBL-E-acquisitiepercentages onder reizigers naar Azië is waarschijnlijk het gevolg van de wijde verspreiding van ESBL-E in dit werelddeel en daarmee het hoge risico op besmetting van voedsel. Risicofactoren geassocieerd met voedsel kunnen om deze reden per reisbestemming verschillen, en kunnen daarom mogelijk gemist zijn in eerdere studies waarin analyses niet werden gestratificeerd op reisbestemming. In de algemene analyse was het eten van voedsel van straatverkopers geassocieerd met een verhoogd risico op ESBL-E-acquisitie. Echter, in de gestratificeerde analyse waren in Zuid-Azië het nuttigen van een maaltijd in een hostel of guesthouse en in Zuidoost-Azië het eten van rauwe groenten, risicofactoren.
Hoewel de frequentie van ESBL-E-acquisitie tamelijk consistent is, rond de 30%, in de bestaande studies, varieert ESBL-dragerschap van 5% tot 24% tot 6 maanden na terugkomst van de reis. In onze studie vonden we dat 65 (11.3%) van de 577 reizigers die een ESBL-E hadden opgelopen tijdens de reis 12 maanden na terugkomst nog steeds gekoloniseerd (persisterend en intermitterend) waren. Hoewel onze studie zich heeft gericht op asymptomatisch dragerschap van ESBL-E, is aangetoond dat internationaal reizen geassocieerd is met ESBL-E-infectie onder patiënten in de open populatie en in het ziekenhuis. (23,24) Afhankelijk van het lokale beleid, zou daarom aanpassing van de empirische antimicrobiële therapie moeten worden overwogen in patiënten die recent terug gekomen zijn van een internationale reis.
Onze bevindingen geven aan dat stammen of plasmiden die CTX-M-groep 9-ESBL-genen bij zich dragen, een kolonisatievoordeel hebben dat resulteert in een langere kolonisatieduur. Dit komt overeen met andere studies die laten zien dat deze genen geassocieerd zijn met een langere duur van dragerschap in terugkerende reizigers uit Azië, in patiënten in de open populatie en in patiënten in het ziekenhuis. (25,26) Bovendien was in de huidige studie de kolonisatieduur langer in reizigers met ESBL-producerende E. coli (Escherichia coli) ten opzichte van reizigers met ESBL- producerende K. pneumoniae. Dit kan mogelijk verklaard worden door aanvullende kolonisatiefactoren, zoals P-fimbriae of aerobactine, of verschillen in bacteriële conditie en plasmidestabiliteit tussen E. coli en K. pneumoniae. (27,28)
Het mathematische model dat rekening hield met factoren als totaal aantal huishoudleden, schatte een transmissiekans van 12% van ESBL-E na introductie in huishoudens van reizigers. In huishoudens van recent ontslagen patiënten uit het ziekenhuis, rapporteerde Hilty en collega’s (29) transmissie van ESBL-E naar 20 (22.7%) van de 88 huishoudleden. Dit hogere risico kan mogelijk verklaard worden door meer frequente en langere expositietijden tussen zorgverlenende huishoudleden en ontslagen patiënten. Het toepassen van handhygiëne kan mogelijk het risico op ESBL-E-transmissie binnen het huishouden verminderen. (30)
Onze studie heeft enkele beperkingen. Ten eerste, zal onze studiepopulatie waarschijnlijk meer welgesteld en gezonder zijn dan gemiddeld geldt voor de algemene bevolking, zoals in de meeste epidemiologische studies. Dit zou kunnen hebben geleid tot selectie waardoor de frequentie van ESBL-E-acquisitie en statistische power (powercalculatie die voorafgaand is berekend (11)) en generaliseerbaarheid van de resultaten zijn beïnvloed. Echter, wanneer bias zich voor zou doen, zou de selectie een effect moeten hebben op de expositie en uitkomst, wat onwaarschijnlijk is in prospectieve cohortstudies. Ook is het onwaarschijnlijk dat (selectieve) uitval onze conclusies heeft beïnvloed, omdat er slechts minimale uitval tijdens de follow-up was, en de follow-up in 92.2% van de reizigers 12 maanden na terugkomst werd afgerond. Ten tweede, zou in theorie fecale kruiscontaminatie tijdens het verzamelen van ontlastingsmonsters, de schattingen voor kolonisatie en transmissie kunnen hebben beïnvloed. Door het aanbieden van duidelijke instructies voor het verzamelen van ontlastingsmonsters, inclusief plaatjes, is getracht dit risico te verminderen. Tot slot bleek uit de resultaten dat er sprake was van een zeer lage achtergrondtransmissie. Doordat we alleen het genotype hebben bepaald van het ESBL-gen, en we geen moleculaire typering hebben gedaan van de ESBL-producerende stammen of mobiele genetische elementen, kan er enige overschatting zijn van de kolonisatieduur en transmissie binnen het huishouden. Wanneer een deelnemer op verschillende meetmomenten hetzelfde ESBL-gentype bij zich draagt, kan niet worden uitgesloten dat de deelnemer het index ESBL-gen heeft verloren en een nieuw ESBL-gen, met hetzelfde genotype als het index ESBL-gen, heeft verkregen van buiten het huishouden.
320 miljoen mensen per jaar bezoeken Azië, Noord-Afrika, en het Midden-Oosten en om deze reden kan worden verwacht dat internationaal reizen een aanzienlijke bijdrage levert aan de toename en verspreiding van ESBL-E in de landen van herkomst van deze reizigers. Wanneer we rekening houden met het totaal aantal Nederlandse reizigers dat deze regio’s per jaar bezoeken, schatten we dat elk jaar tussen de 3,0% en 7,1% van de Nederlandse bevolking een ESBL-E oploopt tijdens reizen naar bestemmingen buiten Europa, Noord-Amerika en Oceanië.
Samenvattend, met een acquisitiepercentage van 34,3% en langere kolonisatieduur na acquisitie in 11.3% van de reizigers 12 maanden na terugkomst, plus een transmissiekans van 12% binnen het huishouden, steunen onze bevindingen de stelling dat internationaal reizen substantieel bijdraagt aan de toename en verspreiding van ESBL-E en antimicrobiële resistentie wereldwijd. Echter de mate van ernst van de gevolgen die hieruit voortvloeien zal per regio verschillen, en sterk afhankelijk zijn van de prevalentie van antimicrobiële resistentie in het land van herkomst van de reiziger.
Deze studie is gefinancieerd door de Nederlandse organisatie voor gezondheidsonderzoek en zorg-
innovatie (ZonMw, subsidienummer 205200003).
Dit artikel is een Nederlandse bewerking van: Arcilla MS (Multiple Sclerose ), Van Hattem JM (Joint meeting), Haverkate MR (antimicrobial resistance), et al. Import and spread of extended-spectrum β-lactamase-producing Enterobacteriaceae by international travellers (COMBAT study): a prospective, multicentre cohort study. Lancet Infect Dis 2017;17(1):78-85.
Auteurs
M. S. Arcilla1, J. M. van Hattem2, M. R. Haverkate3, M. C.J. Bootsma3,4, P. J.J. van Genderen5, A. Goorhuis6, M. P. Grobusch6, A. M. Oude Lashof7, N. Molhoek5, C. Schultsz2, E. E. Stobberingh7, H. A. Verbrugh1, M.D. de Jong2, D. C. Melles1, J. Penders7,8
1. Afdeling Medische Microbiologie en Infectieziekten, Erasmus MC (Erasmus University Medical Center), Rotterdam
2. Afdeling Medische Microbiologie, Academisch Medisch Centrum, Amsterdam
3. Julius Centrum voor Gezondheidswetenschappen en Eerstelijns Geneeskunde, Universitair Medisch Centrum Utrecht
4. Afdeling Wiskunde, Faculteit Bètawetenschappen, Universiteit Utrecht
5. Instituut voor Tropische Ziekten, Havenziekenhuis, Rotterdam
6. Tropencentrum AMC, Academisch Medisch Centrum, Universiteit van Amsterdam
7. School for Public Health and Primary Care, Afdeling Medische Microbiologie, Maastricht UMC (Universitair Medisch Centrum)+
8. School for Nutrition and Translational Research in Metabolism, Maastricht UMC+
Correspondentie
- Appelbaum PC. 2012 and beyond: potential for the start of a second pre-antibiotic era? J Antimicrob Chemother 2012; 67(9): 2062-8.
- El Salabi A, Walsh TR, Chouchani C. Extended spectrum beta-lactamases, carbapenemases and mobile genetic elements responsible for antibiotics resistance in Gram-negative bacteria. Crit Rev Microbiol 2013; 39(2): 113-22.
- (UNWTO) WTO. UNWTO tourism highlights, 2014 edition. Madrid: UNTWO; 2014. Available from: http://wwwe-unwtoorg/doi/pdf/1018111/9789284416226
- Carattoli A. Plasmids and the spread of resistance. Int J Med Microbiol 2013; 303(6-7): 298-304.
- Schultsz C, Geerlings S. Plasmid-mediated resistance in Enterobacteriaceae: changing landscape and implications for therapy. Drugs 2012; 72(1): 1-16.
- Hassing RJ, Alsma J, Arcilla MS (Multiple Sclerose ), van Genderen PJ, Stricker BH, Verbon A. International travel and acquisition of multidrug-resistant Enterobacteriaceae: a systematic review. Euro Surveill 2015; 20(47).
- Ruppe E, Armand-Lefevre L, Estellat C, et al. High Rate of Acquisition but Short Duration of Carriage of Multidrug-Resistant Enterobacteriaceae After Travel to the Tropics. Clin Infect Dis 2015; 61(4): 593-600.
- Kantele A, Laaveri T, Mero S, et al. Antimicrobials increase travelers' risk of colonization by extended-spectrum betalactamase-producing Enterobacteriaceae. Clin Infect Dis 2015; 60(6): 837-46.
- Paltansing S, Vlot JA, Kraakman ME, et al. Extended-spectrum beta-lactamase-producing enterobacteriaceae among travelers from the Netherlands. Emerg Infect Dis 2013; 19(8): 1206-13.
- Ostholm-Balkhed A, Tarnberg M, Nilsson M, Nilsson LE, Hanberger H, Hallgren A. Travel-associated faecal colonization with ESBL (Extended spectrum beta-lactamases)-producing Enterobacteriaceae: incidence and risk factors. J Antimicrob Chemother 2013; 68(9): 2144-53.
- Arcilla MS, van Hattem JM (Joint meeting), Bootsma MC (medisch centrum), et al. The Carriage Of Multiresistant Bacteria After Travel (COMBAT) prospective cohort study: methodology and design. BMC Public Health 2014; 14: 410.
- Bernards AT BM, Cohen Stuart J et al. NVMM (Nederlandse Vereniging voor Medische Microbiologie) Guideline Laboratory detection of highly resistant microorganisms (HRMO). http://wwwnvmmnl/richtlijnen/hrmo-laboratory-detection-highly-resistant… 2012.
- Bursac Z, Gauss CH (Congenitale hypothyreoidie), Williams DK, Hosmer DW. Purposeful selection of variables in logistic regression. Source Code Biol Med 2008; 3: 17.
- Arcilla MS, van Hattem JM, Matamoros S, et al. Dissemination of the mcr-1 colistin resistance gene. Lancet Infect Dis 2016; 16(2): 147-9.
- van Hattem JM, Arcilla MS, Bootsma MC, et al. Prolonged carriage and potential onward transmission of carbapenemase-producing Enterobacteriaceae in Dutch travelers. Future Microbiol 2016; 11: 857-64.
- Sullivan A, Edlund C, Nord CE (Conformité Européenne). Effect of antimicrobial agents on the ecological balance of human microflora. Lancet Infect Dis 2001; 1(2): 101-14.
- Youmans BP (Britse Farmacopee), Ajami NJ, Jiang ZD, et al. Characterization of the human gut microbiome during travelers' diarrhea. Gut Microbes 2015; 6(2): 110-9.
- Sheehan D, Moran C, Shanahan F. The microbiota in inflammatory bowel disease. J Gastroenterol 2015; 50(5): 495-507.
- Jernberg C, Lofmark S, Edlund C, Jansson JK. Long-term impacts of antibiotic exposure on the human intestinal microbiota. Microbiology 2010; 156(Pt 11): 3216-23.
- Dethlefsen L, Huse S, Sogin ML, Relman DA. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing. PLoS (Plos One) Biol 2008; 6(11): e280.
- Kantele A. A call to restrict prescribing antibiotics for travellers' diarrhea--Travel medicine practitioners can play an active role in preventing the spread of antimicrobial resistance. Travel Med Infect Dis 2015; 13(3): 213-4.
- Kantele A, Mero S, Kirveskari J, Laaveri T. Increased Risk for ESBL-Producing Bacteria from Co-administration of Loperamide and Antimicrobial Drugs for Travelers' Diarrhea(1). Emerg Infect Dis 2016; 22(1): 117-20.
- Laupland KB, Church DL, Vidakovich J, Mucenski M, Pitout JD (Creutzfeldt-Jakob). Community-onset extended-spectrum beta-lactamase (ESBL) producing Escherichia coli: importance of international travel. J Infect 2008; 57(6): 441-8.
- Epelboin L, Robert J, Tsyrina-Kouyoumdjian E, Laouira S, Meyssonnier V, Caumes E. High Rate of Multidrug-Resistant Gram-Negative Bacilli Carriage and Infection in Hospitalized Returning Travelers: A Cross-Sectional Cohort Study. J Travel Med 2015; 22(5): 292-9.
- Titelman E, Hasan CM, Iversen A, et al. Faecal carriage of extended-spectrum beta-lactamase-producing Enterobacteriaceae is common 12 months after infection and is related to strain factors. Clin Microbiol Infect 2014; 20(8): O508-15.
- Barreto Miranda IDM, Ignatius RPDM, Pfuller RDM (Rijksdriehoeksmeting), et al. High carriage rate of ESBL-producing Enterobacteriaceae at presentation and follow-up among travellers with gastrointestinal complaints returning from India and Southeast Asia. J Travel Med 2016; 23(2).
- Cottell JL, Webber MA, Piddock LJ. Persistence of transferable extended-spectrum-beta-lactamase resistance in the absence of antibiotic pressure. Antimicrob Agents Chemother 2012; 56(9): 4703-6.
- Nowrouzian FL, Adlerberth I, Wold AE (alveolaire echinokokkose). Enhanced persistence in the colonic microbiota of Escherichia coli strains belonging to phylogenetic group B2: role of virulence factors and adherence to colonic cells. Microbes Infect 2006; 8(3): 834-40.
- Hilty M, Betsch BY, Bogli-Stuber K, et al. Transmission dynamics of extended-spectrum beta-lactamase-producing Enterobacteriaceae in the tertiary care hospital and the household setting. Clin Infect Dis 2012; 55(7): 967-75.
- Bloomfield SF, Cookson B, Falkiner F, Griffith C, Cleary V. Methicillin-resistant Staphylococcus aureus, Clostridium difficile, and extended-spectrum beta-lactamase-producing Escherichia coli in the community: assessing the problem and controlling the spread. Am J Infect Control 2007; 35(2): 86-8.