Pasgeboren baby’s kunnen geïnfecteerd raken met cytomegalovirus (CMV) via de borstvoeding van hun moeder als zij eerder in haar leven een CMV-infectie heeft gehad. Voldragen pasgeboren baby’s ondervinden hiervan geen problemen, maar bij prematuur geboren baby’s kan een CMV-infectie resulteren in een (mild) ziektebeeld. Omdat onduidelijk is wat de langetermijneffecten van deze zogenoemde postnatale CMV-infecties zijn, wordt in sommige landen de borstvoeding gedurende een nacht tot enkele dagen bij wisselende temperaturen ingevroren of gepasteuriseerd, wat ten koste gaat van de kwaliteit. Dit promotieonderzoek heeft zich gericht op de korte- en langetermijneffecten van een postnatale CMV-infectie.
content
Auteur(s): J. Nijman,
Infectieziekten Bulletin: oktober 2015, jaargang 26, nummer 8
Cytomegalovirus
Het cytomegalovirus is een van de grootste DNA (deoxyribonucleic acid)-virussen en wordt zoals de meeste virussen in de herpesvirusfamilie gekenmerkt door latentie: de mogelijkheid om na besmetting aanwezig te blijven in het lichaam. Door nog onvolledig opgehelderde mechanismen wordt het virus met enige regelmaat geactiveerd en is er sprake van chronische verspreiding van het virus. De verspreiding van het virus kan plaats vinden via alle lichaamsvloeistoffen, inclusief speeksel, bloed, urine en moedermelk.
Pasgeboren baby’s kunnen op meerdere manieren geïnfecteerd raken met CMV en daarvan nadelige gevolgen ondervinden. Zo kunnen zwangere moeders die nog niet eerder met CMV in aanraking zijn gekomen, geïnfecteerd raken tijdens de zwangerschap en de infectie intra-uterien overdragen aan de foetus. Dit wordt een congenitale CMV-infectie genoemd. Een congenitale CMV-infectie kan bij kinderen van moeders die wel eerder een infectie hebben doorgemaakt ook ontstaan door CMV-reactivatie of re-infectie met een andere stam. In Nederland is er bij ongeveer 5 op 1000 zwangerschappen sprake van een congenitale CMV-infectie bij de pasgeboren baby, waarvan 10% gezondheids-
problemen heeft bij de geboorte, zoals icterus, hepatomegalie en (ernstige) cerebrale schade met als gevolg ontwikkelingsstoornissen en epilepsie. Van de 90% baby’s met een niet- symptomatische infectie heeft 10-15% kans om alsnog symptomen te krijgen op oudere leeftijd (3 maanden tot 8 jaar), bijvoorbeeld perceptief gehoorverlies. Een voldoende werkzaam en veilig vaccin is nog niet beschikbaar. De behandeling - na de geboorte - met antivirale medicatie staat nog ter discussie.
Postnatale CMV-infectie
In dit proefschrift werd voornamelijk gekeken naar een CMV-infectie na de geboorte, oftewel een postnatale CMV-infectie. Uit eerdere studies is gebleken dat deze postnatale infectie voornamelijk wordt veroorzaakt door geïnfecteerde moedermelk. In tegenstelling tot voldragen baby’s, kan een postnatale CMV-infectie bij prematuur geboren baby’s symptomen veroorzaken (sepsisachtig ziektebeeld, pneumonie, hepatitis, neutropenie en trombocytopenie). Om die reden wordt in sommige landen de moedermelk ingevroren of gepasteuriseerd om een infectie te voorkomen. Daarnaast wordt sporadisch gekozen voor antivirale behandeling bij prematuur geboren baby’s met een ernstig verlopende postnatale CMV-infectie. Het was echter nog grotendeels onduidelijk waarom sommige te vroeg geboren baby’s deze ziekte krijgen, waarom deze soms symptomatisch verloopt en wat de langetermijngevolgen van een dergelijke infectie zijn.
Risicofactoren
In ons onderzoek, uitgevoerd op de neonatale intensive care unit (NICU) van het Wilhelmina Kinderziekenhuis te Utrecht, werd in eerste instantie een cohort van 315 prematuur geboren baby’s (zwangerschapsduur < 32 weken) onderzocht op de aanwezigheid van een postnatale CMV-infectie. Dit werd gedaan door een polymerase chain reaction(PCR-)test uit te voeren op urine verkregen binnen 2 weken na de geboorte en op voldragen leeftijd. Indien de PCR (polymerase chain reaction) negatief was na de geboorte en positief op voldragen leeftijd was er sprake van een postnatale CMV-infectie. Uiteindelijk hadden 39 van de 315 (12%) pasgeboren baby’s een postnatale CMV-infectie. In tegenstelling tot eerdere studies waarin tot 48% van de prematuur geboren baby’s met een postnatale CMV-infectie klinische symptomen had, had de meerderheid (85%) van de geïnfecteerde baby’s in onze groep geen symptomen. Met behulp van multivariabele logistische regressie-analyse werden de volgende onafhankelijke risicofactoren voor een postnatale CMV-infectie in prematuur geboren baby’s vastgesteld:
- allochtone afkomst van de moeder (Odds ratio (OR) 9.6 [95% betrouwbaarheidsinterval (CI) 4.3-21.5]);
- zwangerschapsduur (OR 0.7 [95% CI (Canadian Intense) 0.5-0.9]);
- borstvoeding (OR 13.2 [95% CI 1.7-104.5]).
Overdracht van moeder op kind
Eerder is gesuggereerd dat een grote hoeveelheid maternale anti-CMV-antistoffen (anti-CMV IgG (Immunoglobulin G)) geassocieerd is met een groter risico op CMV-overdracht van moeder op kind. Om dit verder te onderzoeken onderzochten we de hoeveelheid anti-CMV IgG in het bloed van 79 moeders en hun 94 baby’s, binnen 3 dagen na de geboorte. Negenendertig van de 94 (41%) onderzochte baby’s kreeg een postnatale CMV-infectie. We hebben geen significantie relatie kunnen vaststellen tussen absolute hoeveel-heden anti-CMV IgG van moeders of baby’s en het risico op CMV-infectie van moeder op kind.
Ernst van de ziekte
CMV load
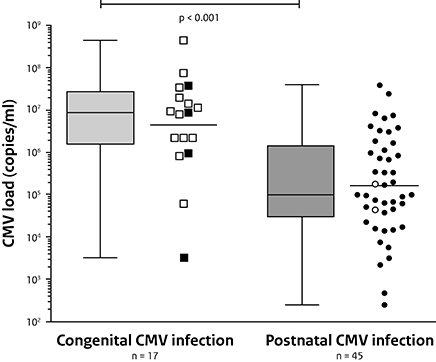
Bij baby’s met een congenitale CMV-infectie werd eerder aangetoond dat er een relatie is tussen de hoeveelheid CMV-kopieën in de urine en het bloed (CMV load) en de ernst van de ziekte: baby’s met symptomen hadden een hogere CMV load dan baby’s zonder symptomen. Ook de latere ontwikkeling van gehoorverlies was geassocieerd met een hogere CMV load. Om die reden werd de CMV load in de urine van 45 baby’s met een postnatale CMV-infectie vergeleken met de CMV load in urine van 17 baby’s met een congenitale CMV-infectie. Hierbij was de CMV load van baby’s met een congenitale CMV-infectie significant hoger dan bij baby’s met een postnatale CMV-infectie. (figuur 1) Dit lijkt ook passend bij het voornamelijk asymptomatische verloop van een postnatale CMV-infectie.
Figuur 1 CMV-load (kopieën/ml) bij kinderen met een congenitale CMV-infectie en een postnatale CMV-infectie
CMV-genotype
Bij baby’s met een congenitale CMV-infectie werd eerder gesuggereerd dat bepaalde – meer virulente – CMV-genotypen geassocieerd zijn met ernstiger symptomen. Voor het bepalen van een CMV-genotype worden de sequenties van meerdere (kapsel)eiwitten gebruikt, waarbij de meest gangbare CMV UL55 en UL144 zijn. De verdeling van de CMV UL55- en UL144- genotypen werd bepaald bij 58 prematuur geboren baby’s met een postnatale CMV-infectie en 13 prematuur geboren baby’s met een congenitale CMV-infectie. Hieruit bleek dat de verdeling van verschillende genotypen niet verschillend was, terwijl de ziektelast bij congenitaal geïnfecteerde kinderen gemiddeld hoger was. Dit kan suggereren dat de ernst van de ziekte niet afhankelijk is van het genotype.
Gevolgen van een postnatale CMV-infectie
Er zijn weinig studies over de langetermijneffecten van een postnatale CMV-infectie in prematuur geboren kinderen. Omdat bekend is dat CMV-cellen van het zenuwstelsel kan infecteren, waren we geïnteresseerd in beeldvorming van de hersenen.
Echografie
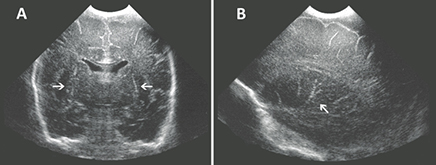
Met behulp van cerebrale echografie kon de ontwikkeling van verkalkingen van de lenticulostriatale vaten in de basale ganglia (lenticulostriatale vasculopathie – LSV, afbeelding 1) worden geassocieerd met een postnatale CMV-infectie (OR 4.1 [95% CI 1.9-8.8]). Deze associatie was al eerder beschreven bij baby’s met een congenitale CMV-infectie.
Afbeelding 1 Echografie van de hersenen op voldragen leeftijd van een prematuur geboren baby (zwangerschapsduur 28 weken) met een postnatale CMV-infectie. Op de coronale (A) en sagittale (B) beelden wordt bilaterale lenticulostriatale vasculopathie (LSV) gezien (witte pijlen).
Voor het bepalen van wittestofschade, door bijvoorbeeld infectie, wordt bij prematuur geboren baby’s vaak een MRI (magnetic resonance imaging)-scan verricht. Met behulp van standaard MRI-protocollen (zoals T1- en T2-gewogen scans) konden geen afwijkingen worden aangetoond bij prematuur geboren baby’s met een postnatale CMV-infectie. Echter, door het gebruik van diffusion tensor imaging (DTI) konden we microstructurele afwijkingen in het achterste gedeelte (occipitale regio) van de hersenen aantonen (wanneer dit vergeleken werd met niet-geïnfecteerde baby’s). Bij DTI wordt de snelheid en richting van de diffusie van water in de hersenen bepaald om structurele wittestofveranderingen aan te tonen. Er waren echter geen verschillen in ontwikkeling bij de leeftijd van 2 jaar, dus het is vooralsnog onduidelijk of deze afwijkingen klinisch relevant zijn.
Gehoorverlies
Een congenitale CMV-infectie kan resulteren in perceptief gehoorverlies, zowel direct na de geboorte als op latere leeftijd. Om die reden werd bij 64 prematuur geboren baby’s met een postnatale CMV-infectie het gehoor getest in het eerste levensjaar en bij 18 peuters in het tweede levensjaar; bij geen van hen ontwikkelde zich perceptief gehoorverlies.
Ontwikkeling
Tenslotte werd de cognitieve en motorische ontwikkeling van het gehele cohort prematuur geboren baby’s met of zonder een postnatale CMV-infectie in kaart gebracht met behulp van de Griffiths Mental Developmental Scales (GMDS) en de Bayley Scales of Infant and Toddler Development (BSID-III). Bij een gecorrigeerde leeftijd van 16 maanden werd de GMDS uitgevoerd in 390 prematuur geboren baby’s, waarvan er 57 (15%) een postnatale CMV-infectie hadden opgelopen voor de voldragen leeftijd. Vervolgens werd op de gecorrigeerde leeftijd van 24 maanden een BSID-III afgenomen in 328 baby’s, waarvan er 53 (16%) een postnatale CMV-infectie hadden. Verder werd er in 12 CMV-positieve baby’s en 55 CMV-negatieve baby’s een GMDS afgenomen in plaats van de BSID-III.
Het was opvallend dat op een leeftijd van 16 maanden de met CMV-geïnfecteerde kinderen een betere grove motorische ontwikkeling (los lopen, bal vangen, etc.) hadden dan de niet geïnfecteerde kinderen. Er waren geen verschillen in algemene ontwikkeling. Met behulp van de meer gedetailleerde BSID-III op een leeftijd van 24 maanden werden geen verschillen gevonden. Echter, kinderen met een postnatale CMV-infectie begonnen significant vroeger met los lopen in vergelijking met niet geïnfecteerde kinderen. Multivariabele regressieanalyse toonde dat niet-Nederlandse etniciteit (en niet de postnatale CMV-infectie) hoogstwaarschijnlijk verantwoordelijk is voor dit verschil.
Conclusie
In dit proefschrift werd aangetoond dat een postnatale CMV-infectie in prematuur geboren baby’s meestal asymptomatisch verloopt en hoogstwaarschijnlijk niet resulteert in gehoorproblemen of een vertraagde ontwikkeling op een gecorrigeerde leeftijd van 2 jaar. Omdat de nadelen van preventieve maatregelen, zoals het invriezen, pasteuriseren of zelfs onthouden van borstvoeding hoogstwaarschijnlijk niet opwegen tegen de risico’s van een postnatale CMV-infectie, lijken deze maatregelen niet noodzakelijk. Geen van de kinderen met een postnatale CMV-infectie die werden bestudeerd in dit proefschrift hebben antivirale medicatie of intraveneuze anti-CMV-antilichamen gekregen. Behandeling van prematuur geboren baby’s met een postnatale CMV-infectie zou alleen moeten worden overwogen als er sprake is van levensbedreigende symptomen.
Auteur
J. Nijman, Wilhelmina Kinderziekenhuis, UMC (Universitair Medisch Centrum) Utrecht