Acute luchtweginfecties zorgen voor veel problemen op de kinderleeftijd en worden veroorzaakt door een virale en/of bacteriële verwekker. De nasopharynx wordt gezien als de niche waaruit respiratoire infecties ontstaan. Bacteriën zoals Streptococcus pneumoniae (pneumokok), Haemophilus influenzae, Moraxella catarrhalis en Staphylococcus aureus zijn veelvoorkomende verwekkers van respiratoire ziekte, maar komen ook vaak in de nasopharynx voor zonder dat ze symptomen veroorzaken (dragerschap). Met name kinderen en ouderen zijn vaak drager van deze bacteriën. Dit komt door hun respectievelijk immature en verouderde immuunsystemen.
ib januari 2014
Auteurs: A. A.T. M. Bosch , D. Bogaert namens de onderzoeksgroep Pathogenese en preventie van luchtweginfecties
Infectieziekten Bulletin, jaargang 25, nummer 1, januari 2014
Kolonisatie van de nasopharynx is een dynamisch proces waarbij er interacties plaatsvinden tussen verschillende bacteriesoorten en virussen die zich hier bevinden. De ene bacteriesoort kan ervoor zorgen dat een andere bacteriesoort zich kan vestigen (synergisme), of er kan competitie plaatsvinden tussen verschillende soorten.(1) De gevestigde microben vormen samen een microsamenleving: het microbioom. Het microbioom vervult over het algemeen een gunstige rol voor de mens; zo stimuleert het de ontwikkeling van het immuunsysteem en de barrièrefunctie van de slijmvliezen, helpt bij de vertering van voedingsstoffen en maakt essentiële vitaminen vrij uit de voeding. Virussen worden ook vaak gevonden in neuskweken van gezonde kinderen. Kolonisatie van een nieuwe bacterie of virus kan echter wel zorgen dat het evenwicht in het microbioom wordt verstoord, waardoor pathogene bacteriën kans hebben om de niche te overgroeien, zich te verspreiden naar het middenoor of de longen of zelfs de mucosale barrière te doorbreken en sepsis of meningitis te veroorzaken. In de dynamiek van blootstelling aan bacteriën en virussen spelen ook andere factoren een rol, te denken aan het immuunsysteem en omgevingsfactoren zoals seizoen, het hebben van broertjes en zusjes en vaccinaties. (2)
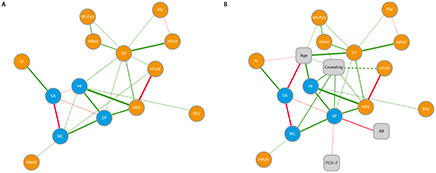
Figuur 1 Model van de interacties tussen de belangrijkste potentieel pathogene bacteriën en veel voorkomende virussen gebaseerd de uitkomsten van conventionele kweektechnieken (Bron: Van den Bergh et al. (3))
Interactie tussen bacteriën en virussen in de nasopharynx (A) en interactie tussen bacteriën en virussen in de nasopharynx en epidemiologische determinanten (B). Bacteriën zijn weergegeven in blauw, respiratoire virussen in oranje en risicofactoren in grijze boxen. De doorgetrokken lijn geeft een associatie met een p-waarde <0.01 weer, stippellijn een associatie met een p-waarde tussen 0.01 en 0.05. Een positieve correlatie wordt weergegeven met een groene lijn, een negatieve correlatie met een rode lijn.
Afkortingen: SP (Sustainable Procurement), S. pneumoniae; HI, H. influenzae; MC (medisch centrum), M. catarrhalis; SA, S. aureus; HRV, humaan rhinovirus, EV (externe veiligheid), enterovirus; HBoV, humaan bocavirus; WUPyV, WU polyomavirus; HCoV, humaan coronavirus; PIV, para-influenzavirus; HAdV, humaan adenovirus; IV (Informatievoorziening), influenzavirus; HPeV, human parechovirus; RSV (Respiratoir Syncytieel Virus), respiratory syncytial virus; AB, antibioticagebruik minder dan 2 maanden voor de sampling; ‘crowding’, het hebben van broertjes of zusjes; PCV-7, 7-valent pneumokokkenvaccin
Het spel tussen virussen en bacteriën in de nasopharynx
Om meer inzicht te krijgen in de interacties tussen de belangrijkste potentieel pathogene bacteriën en veel voorkomende virussen, onderzochten we bacterieel en viraal dragerschap bij 433 gezonde, asymptomatische kinderen op de leeftijd van 6, 12, 18 en 24 maanden oud (n=288, n=198, n=298 en n=202 respectievelijk). (3) Deze kinderen namen deel aan een cohortonderzoek waarbij werd gekeken naar de effectiviteit van het 7-valente pneumokokkenvaccin, uitgevoerd tussen november 2005 en januari 2008 in het westen van Nederland. Bij 60-76% van de kinderen vonden we afhankelijk van de leeftijd van het kind meerdere (potentieel) pathogene bacteriën in de nasopharynx. Bij 58-74% van de kinderen werd een virus aangetroffen en bij 18-38% meerdere virussen. Interactiestudies toonden aan dat pneumokokkendragerschap significant gecorreleerd was met H. influenzae- en M. catarrhalis-dragerschap en met de aanwezigheid van humaan rhinovirus en enterovirus. Daarentegen werd de pneumokok minder vaak aangetroffen in combinatie met S. aureus. Deze competitie is ook eerder beschreven in andere onderzoeken (1) en zou er mogelijk toe hebben geleid dat na invoering van het pneumokokkenvaccin er een toename werd gezien in S. aureus-gerelateerde otitiden. (4) In figuur 1 staat een model van de gevonden interacties gebaseerd op conventionele kweektechnieken.
De laatste jaren zijn er nieuwe technieken ontwikkeld, zoals next generation sequencing. Hierdoor is het mogelijk geworden om bacteriesoorten te detecteren die met kweektechnieken niet gedetecteerd konden worden. In tegenstelling tot kweektechnieken waarmee 70% van de bacteriën die voorkomen in de nasopharynx niet gedetecteerd kunnen worden, kan door sequencing wel het gehele microbioom worden bestudeerd. Dit heeft toegevoegde waarde omdat daarmee ook de gezonde ofwel commensale flora in kaart kan worden gebracht. Onze hypothese is dat als het microbioom in balans is, de ‘gunstige’ commensalen ervoor kunnen zorgen dat de potentieel pathogene bacteriën niet kunnen overgroeien waardoor de progressie naar ziekte wordt voorkomen.
Om het microbioom van de nasopharynx in kaart te brengen hebben we neuswatten van 96 gezonde kinderen van 18 maanden oud onderzocht met next generation sequencing. (5) De kinderen waren willekeurig geselecteerd uit het onderzoekscohort dat de effectiviteit van het 7-valente pneumokokkenvaccin onderzocht. Bij 50 kinderen werd de neuswat afgenomen in de herfst/winter, bij 46 kinderen in de lente. We vonden in totaal bijna 250 bacteriesoorten in de nasopharynxmonsters. De meest voorkomende waren de potentieel pathogene soorten Moraxella, Haemophilus, Streptococcus en Neisseria en de commensalen Dolosigranulum- en Coryne-bacteriën. Ook vonden we een opvallend verschil in samenstelling tussen luchtwegmicrobiota in de herfst/winter en het voorjaar. In de monsters die waren afgenomen in de lente werden meer bacteriën gevonden die geassocieerd zijn met een beschermend effect tegen overgroei van pathogene bacteriën, zoals Bacteroidetes-, (Brevi)bacillus- en Lactobacillus-species, in vergelijking met de monsters afgenomen in de herfst/winter. Dit suggereert dat het microbioom in de lente meer in balans is dan in de herfst/winter en mogelijk bijdraagt aan het verhoogde risico op luchtweginfecties in de herfst/winter in vergelijking met de lente.
De aanwezigheid van virussen in het algemeen verklaarde dit verschil echter niet. Preliminaire data van een uitgebreidere groep kinderen laten nochtans zien dat er significante verschillen bestaan tussen het microbioom met en zonder luchtwegvirussen, waarbij niet alleen een grotere densiteit aan potentieel pathogenen wordt gevonden in combinatie met virussen, maar ook minder commensalen.
Conclusie
Sommige virussen, zoals RSV en influenzavirus zijn duidelijk geassocieerd met luchtweginfecties. Voor andere virussen is dat verband minder duidelijk, omdat veel kinderen drager zijn van virussen zonder dat dit symptomen veroorzaakt. Toch weten we dat bacteriële luchtweginfecties meestal voorafgegaan worden door een viraal infect. Dit geldt bijvoorbeeld voor humaan rhinovirus, bocavirus en coronavirussen. Microbioomstudies bij gezonde en zieke kinderen vergroten het inzicht in de mogelijk meer subtiele rol van deze virussen in de (patho)fysiologie van luchtweginfecties, bijvoorbeeld bij de samenstelling van de commensale flora.
De eerste stappen zijn gezet, maar longitudinaal onderzoek is nodig om oorzaak-en-gevolgrelaties tussen de aanwezigheid van virussen, de samenstelling van het microbioom en het ontstaan van luchtweginfecties vast te stellen. Tevens moet het onderzoek worden uitgebreid naar kinderen met acute luchtweginfecties om ten tijde van de infectie de microbioom samenstelling te kunnen bestuderen.
Uiteindelijk hopen we (groepen) commensale bacteriën te identificeren die verantwoordelijk zijn voor een gezond stabiel microbioom van de luchtwegen. Deze bacteriën kunnen dan een nieuw uitgangspunt zijn om toekomstige therapeutische of preventieve strategieën tegen luchtweginfecties te ontwikkelen.
Een overzicht over dragerschapscijfers van virussen en S. pneumoniae kan respectievelijk in referentie 1 en 2 gevonden worden.
Auteurs
A. A.T. M. Bosch1,2 , D. Bogaert1 namens de onderzoeksgroep Pathogenese en preventie van luchtweginfecties
- Wilhelmina Kinderziekenhuis, Utrecht
- Spaarne Ziekenhuis, Hoofddorp
Correspondentie
referenties
- Bosch AATM, Biesbroek G, Trzcinski K, Sanders EAM (Environmental Assessment Module), Bogaert D. Viral and Bacterial Interactions in the Upper Respiratory Tract. PLoS (Plos One) Pathog 2013;9(1):e1003057.
- Bogaert D, De Groot R, Hermans PW (partnerwaarschuwing). Streptococcus pneumoniae colonisation: the key to pneumococcal disease. Lancet Infect Dis 2004;4:144-154.
- van den Bergh M, Biesbroek G, Rossen JWA, de SP (Sustainable Procurement), Bosch AATM, van Gils, Elske J. M., et al. Associations between Pathogens in the Upper Respiratory Tract of Young Children: Interplay between Viruses and Bacteria. PLoS ONE 2012 10/17;7(10):e47711.
- Veenhoven R, Bogaert D, Uiterwaal C, Brouwer C, Kiezebrink H, Bruin J, et al. Effect of conjugate pneumococcal vaccine followed by polysaccharide pneumococcal vaccine on recurrent acute otitis media: a randomised study. The Lancet 2003 6/28;361(9376):2189-2195.
- Bogaert D, Keijser B, Huse S, Rossen J, Veenhoven R, van Gils E, et al. Variability and Diversity of Nasopharyngeal Microbiota in Children: A Metagenomic Analysis. PLoS One 2011;6(2):e17035.