Sinds de invoering van pneumokokken conjugaatvaccins in het Rijksvaccinatieprogramma (RVP) is de incidentie van invasieve pneumokkenziekte in Nederland netto gedaald, ondanks het feit dat er sprake was van een toename van niet-vaccin serotype ziekte. Bij kinderen en ook bij ouderen wordt de daling in invasieve pneumokkenziekte toegeschreven aan groepsimmuniteit. De bevindingen beschreven in dit artikel tonen dat er ook sprake lijkt te zijn van dergelijke groepsimmuniteit bij volwassenen opgenomen met een thuis opgelopen pneumonie zonder invasieve pneumokkenziekte.
IB juni 2018
Auteurs: G. H.J. Wagenvoort, S. M.T. Vestjens, B. J.M. Vlaminckx, E. M.W. van de Garde
Infectieziekten Bulletin, jaargang 29, nummer 5/6, juni 2018
Invasieve pneumokkenziekte (IPZ) is gedefinieerd als een infectie door de bacterie Streptococcus pneumoniae van een normaal steriele lichaamsvloeistof, zoals bloed en liquor cerebrospinalis. In 2006 werd het 7-valente pneumokokkenconjugaatvaccin (PCV7) ingevoerd in het RVP (Rijksvaccinatie programma)). PCV7 (pneumokokkenconjugaatvaccin 7) heeft de potentie om bescherming te bieden tegen 7 van de ruim 90 pneumokokkenserotypen. In tegenstelling tot pneumokokkenpolysacharidenvaccins zijn conjugaatvaccins in staat om T-celimmuniteit op te wekken waardoor antistoffenbescherming al op jonge leeftijd kan optreden. PCV7 werd in 2011 vervangen door een 10-valent vaccin (PCV10) wat bescherming kan bieden tegen 10 serotypen. Uit surveillance door het RIVM is gebleken dat de incidentie van IPZ na invoering van PCVs is gedaald. In de gevaccineerde leeftijdsgroep (kinderen < 5 jaar) is er sprake van een sterke IPZ-incidentiedaling (van 18.6 naar 7.8 patiënten / 100.000 per jaar). Verder daalde de IPZ-incidentie bij ouderen ≥ 65 jaar door groepsimmuniteit (van 57.6 naar 49.0 patiënten / 100.000 per jaar). De daling van IPZ-incidentie in zowel gevaccineerde- als niet-gevaccineerde leeftijdsgroepen is het gevolg van een afname van vaccinserotypedragerschap in kinderen, waardoor er minder verspreiding in de gemeenschap optreedt (groepsimmuniteit). Ondanks een toename van de incidentie van dragerschap van serotypen waartegen de vaccins niet beschermen en ziekte, is er sprake van een netto IPZ-incidentiedaling.(2,3) (1,2)
Bij volwassenen die in het ziekenhuis worden opgenomen vanwege een thuis opgelopen pneumonie (community-acquired pneumonia, hierna afgekort als CAP) is S. pneumoniae in Nederland de meest aangetoonde verwekker (16%-37%).(3,4) Naar schatting is bij ongeveer 25% van de pneumokokken-CAP-patiënten sprake van een bacteriemie. De meeste van deze patiënten (ongeveer 75%) hebben dus een niet-invasieve ofwel niet-bacteremische pneumokokken-CAP.(5)
Wat het effect is van de pneumokkenvaccinatie van kinderen op pathogeen- en serotypeverdeling bij volwassenen, die opgenomen zijn vanwege een niet-bacteremische (pneumokokken-)CAP, is minder duidelijk. Twee studies onder volwassen patiënten die hiervoor opgenomen waren toonden eerder aan dat vaccinatie van kinderen bescherming lijkt te bieden tegen 7 respectievelijk 13 serotypen waartegen de 2 onderzochte vaccins (PCV7 en PCV13 (Prevenar-13®, een geregistreerd 13-valent pneumokokken-conjugaatvaccin)) bescherming zouden moeten bieden. (6,7)
Onduidelijk is of er in Nederland vergelijkbare effecten zijn opgetreden na de introductie van PCV10 (Synflorix®) in het RVP. Bovendien zouden veranderingen in het aantal patiënten met pneumokokken-CAP gevolgen kunnen hebben voor de pathogeenverdeling in CAP als geheel. Het doel van dit onderzoek was om deze 2 zaken op te helderen.
Opzet/methode
Het onderzoek werd uitgevoerd met data van 3 prospectieve studies (1 cohort en 2 gerandomiseerde trials) onder volwassen patiënten die in het ziekenhuis waren opgenomen met een CAP. Deze 3 studies werden uitgevoerd in de periode voor en na opname van de pneumokkokkenvaccinaties in het RVP (cohort 1 = pre-PCV7; oktober 2004 - augustus 2006, n=201), na aanvang van PCV7 (cohort 2 = PCV7 (en pre-PCV10); november 2007 en juni 2009, n=304) en na aanvang van PCV10 (cohort 3 = PCV10; oktober 2012 en oktober 2016, n=300). De inclusie- en exclusiecriteria van de 3 studies waren vergelijkbaar. (8,9, 10) De patiënten in alle 3 studies waren volwassenen met een radiologisch bewezen CAP. De meeste waren in het St. (sint) Antonius Ziekenhuis opgenomen. De belangrijkste verschillen in criteria waren dat er in cohort 1 patiënten zaten die direct waren opgenomen op een intensivecareafdeling of een indicatie hadden voor systemische corticosteroïden (of huidig gebruik hiervan). In de andere 2 cohorten werden deze patiënten geëxcludeerd.
In alle cohorten werd uitgebreide conventionele microbiologische diagnostiek ingezet: sputum- en bloedkweken, urineantigeentesten op Streptococcus pneumoniae en Legionella pneumophila en PCR (polymerase chain reaction)-testen (polymerase chain reaction) op keelswabs en/of sputum voor atypische pathogenen (Mycoplasma pneumoniae, Legionella pneumophila, Coxiella burnetii, Chlamydophila pneumoniae en Chlamydophila psittaci). Daarnaast werd een aantal patiënten, afhankelijk van het cohort, getest op virale respiratoire verwekkers met serologische testen, viruskweken of PCR.
Bij de patiënten van wie er een vroeg of laat serummonster beschikbaar was, werden aanvullend serotypespecifieke pneumokokkenantistoffen gemeten (vergelijking van titers in serum dat in een vroeg en een later stadium van de ziekte werd afgenomen). Met deze methode kon door middel van specifieke titerstijgingen (voor 14 serotypen) ook de diagnose pneumokokkenpneumonie worden gesteld. Deze methode is elders uitgebreid beschreven.(11) De resultaten van deze test werden alleen meegenomen als er met conventionele diagnostiek geen verwekker was gevonden.
Op basis van de resultaten uit alle diagnostiek werden de patiënten in 4 etiologische categorieën ingedeeld:
- Pneumokokken-CAP
- CAP door een atypisch pathogeen
- CAP door een ander pathogeen
- CAP door een onbekend pathogeen
De patiënten met pneumokokken-CAP bij wie een infecterend serotype kon worden geïdentificeerd (door middel van de kapselzwelling/Quellungreactie of op basis van de serologieuitslag voor 14 serotypen) werden verder onderverdeeld in 4 serotypegroepen:
- PCV7-serotypen (4, 6B, 9V, 14, 18C, 19F of 23F)
- PCV10 extra-serotypen (1, 5 of 7F)
- niet-PCV7-serotypen (1, 5 of 7F of een ander niet PCV7-serotype)
- niet-PCV10-serotypen (niet-vaccinserotypen)
Deze 4 groepen werden verder opgedeeld in bacteremische en niet-bacteremische patiënten.
Proporties van gedetecteerde pathogenen over 3 perioden (pre-PCV7, PCV7 en PCV10) werden met elkaar vergeleken. Proporties van serotypegroepen werden op dezelfde manier vergeleken: tussen alle patiënten, tussen de patiënten met CAP en tussen patiënten met CAP met een bekend serotype. Ten slotte werden de serotypegroepen vergeleken tussen patiënten met een bacteremische pneumonie en degenen met een niet-bacteremische pneumonie.
Resultaten
Populatie
In tabel 1 staan de patiëntkarakteristieken weer op het moment van ziekenhuisopname. Het meest opvallende verschil tussen de perioden is het aandeel patiënten met COPD (Chronic Obstructive Pulmonary Disease (chronische bronchitis of longemfyseem)) in de voorgeschiedenis (p<0.001 tussen de pre-PCV7 en PCV7 + PCV10 periodes).
Tabel 1. Patiëntkarakteristieken van de 3 cohorten
| pre-PCV7 2004-2006 | PCV7 2007-2009 | PCV10 2012-2016 | |
| (n=201) | (n=304) | (n=300) | |
| Geslacht (man) | 124 (62) | 171 (56) | 178 (59) |
| Leeftijd (jaren) | 64 (17) | 63.7 (18) | 64.4 (16) |
| Comorbiditeiten* | |||
| Nierziekte | 10 (5) | 30 (10) | 41 (14) |
| Diabetes mellitus | 35 (17) | 43 (14) | 75 (25) |
| Leverziekte | 0 (0) | 2 (1) | 3 (1) |
| Maligniteit | 26 (13) | 19 (6) | 12 (4) |
| Hartfalen | 19 (10) | 48 (16) | 26 (9) |
| COPD | 64 (32) | 34 (11) | 60 (20) |
| PSI klasse | |||
| Klasse 1-3 | 117 (58) | 161 (53) | 177 (59) |
| Klasse 4-5 | 84 (42) | 143 (47) | 123 (41) |
| Dagen ziek voor opname | 5.2 (4.9) | 5.7 (5.3) | 5.4 (5.4) |
| Antibiotische voorbehandeling | 48 (24) | 82 (27) | 83 (28) |
Data gepresenteerd als aantal (%) of gemiddelde (SD). Afkortingen: PSI, ‘pneumonia severity; COPD, ‘chronic obstructive pulmonary disease’.* gedefinieerd zoals gebruikt om PSI-klassen te berekenen. (12)
Verdeling pathogenen
Figuur 1 laat zien dat de proportie pneumokokken-CAP afnam van 37% in de pre-PCV7-periode naar 26% in de PCV7-periode (RR 0.70, 95% BI: 0.54-0.91). Deze afname ging gepaard met een significante toename van CAP door een atypisch pathogeen (met name Q-koorts en psittacose, Tabel 2). In de PCV10-periode nam de proportie atypische verwekkers weer af, maar de proportie pneumokokken-CAP bleef vrijwel ongewijzigd ten opzichte van de PCV7-periode.
Figuur 1. Proporties van verwekkers binnen CAP-patiënten in de pre-PCV7-, PCV7-, pre-PCV10- en PCV10-perioden
Tabel 2. Proporties van verwekkers binnen CAP-patiënten in de pre-PCV7, PCV7-, pre-PCV10- en PCV10- perioden
|
Pre-PCV7 2004-2006 |
PCV7 2007-2009 |
PCV10 2012-2016 |
PCV7 vs pre-PCV7 |
p- waarde |
PCV10 vs PCV7 |
p- waarde |
PCV10 vs pre-PCV7 |
p- waarde |
|
| (n=201) | (n=304) | (n=300) | |||||||
| No. (%) | No. (%) | No.(%) | RR (Rifampicine resistentie) 95% BI a | RR 95% BI b | RR 95% BI c | ||||
| S.pneumoniae | 74 (37) | 81 (27) | 77 (26) | 0.72 (0.56-0.94) | 0.02 | 0.96 (0.74-1.26) | 0.79 | 0.70 (0.54-0.91) | 0.01 |
| Atypische verwekker | 14 (7) | 57 (19) | 34 (11) | 2.69 (1.54-4.70) | <0.01 | 0.60 (0.41-0.9) | 0.01 | 1.63 (0.90-2.95) | 0.10 |
| Andere verwekker | 27 (13) | 33 (11) | 31 (10) | 0.81 (0.50-1.30) | 0.38 | 0.95 (0.60-1.51) | 0.84 | 0.77 (0.47-1.25) | 0.28 |
| Geen verwekker | 86 (43) | 133 (44) | 158 (53) | 1.02 (0.83-1.25) | 0.83 | 1.20 (1.02-1.42) | 0.03 | 1.23 (1.02-1.49) | 0.03 |
Serotypeverdeling
Tabel 3. Cijfers over de veranderingen in serotypeverdeling
| Pre-PCV7 2004-2006 | PCV7 2007-2009 | PCV10 2012-2016 | PCV7 vs pre-PCV7 | PCV10 vs PCV7 | PCV10 vs pre-PCV7 | |
| No. (%) | No. (%) | No. (%) | RR 95% BI a | RR 95% BI b | RR 95% BI c | |
| Binnen alle CAP-patiënten | 201 (100) | 304 (100) | 300 (100) | |||
| PCV7 | 25 (12) | 13 (4) | 2 (1) | 0.34 (0.18-0.66) | 0.16 (0.04-0.68) | 0.05 (0.01-0.22) |
| PCV10extra | 11 (5) | 12 (4) | 8 (3) | 0.72 (0.32-1.6) | 0.68 (0.28-1.63) | 0.49 (0.2-1.19) |
| niet-PCV10 | 14 (7) | 26 (9) | 34 (11) | 1.23 (0.66-2.29) | 1.33 (0.82-2.15) | 1.63 (0.9-2.95) |
| niet-PCV7 | 25 (12) | 38 (13) | 42 (14) | 1.01 (0.63-1.61) | 1.12 (0.74-1.69) | 1.13 (0.71-1.79) |
| Binnen alle pneumokokken CAP-patiënten | 74 (100) | 81 (100) | 77 (100) | |||
| PCV7 | 25 (34) | 13 (16) | 2 (3) | 0.48 (0.26-0.86) | 0.16 (0.04-0.69) | 0.08 (0.02-0.31) |
| PCV10extra | 11 (15) | 12 (15) | 8 (10) | 1 (0.47-2.12) | 0.7 (0.3-1.62) | 0.7 (0.3-1.64) |
| niet-PCV10 | 14 (19) | 26 (32) | 34 (44) | 1.7 (0.96-2.99) | 1.38 (0.92-2.06) | 2.33 (1.37-3.98) |
| niet-PCV7 | 25 (34) | 38 (47) | 42 (55) | 1.39 (0.94-2.06) | 1.16 (0.85-1.58) | 1.61 (1.11-2.36) |
| Binnen alle pneumokokken CAP | 50 (100) | 51 (100) | 44 (100) | |||
| met bekend serotype | ||||||
| PCV7 | 25 (50) | 13 (25) | 2 (5) | 0.51 (0.3-0.88) | 0.18 (0.04-0.75) | 0.09 (0.02-0.36) |
| PCV10extra | 11 (22) | 12 (24) | 8 (18) | 1.07 (0.52-2.2) | 0.77 (0.35-1.72) | 0.83 (0.37-1.87) |
| niet-PCV10 | 14 (28) | 26 (51) | 34 (77) | 1.82 (1.08-3.06) | 1.52 (1.11-2.07) | 2.76 (1.72-4.43) |
| niet-PCV7 | 25 (50) | 38 (75) | 42 (95) | 1.49 (1.08-2.05) | 1.28 (1.08-1.52) | 1.91 (1.44-2.54) |
| Binnen bacteremische pneumokokken CAP | 17 (100) | 24 (100) | 19 (100) | |||
| met bekend serotype | ||||||
| PCV7 | 11 (65) | 7 (29) | 0 (0) | 0.45 (0.22-0.92) | NA | NA |
| PCV10extra | 5 (29) | 8 (33) | 4 (21) | 1.13 (0.45-2.87) | 0.63 (0.22-1.78) | 0.72 (0.23-2.24) |
| niet-PCV10 | 1 (6) | 9 (38) | 15 (79) | 6.38 (0.89-45.73) | 2.11 (1.19-3.71) | 13.42 (1.98-91.14) |
| niet-PCV7 | 6 (35) | 17 (71) | 19 (100) | 2.01 (1-4.01) | 1.41 (1.09-1.82) | 2.83 (1.49-5.39) |
| Binnen niet-bacteremische pneumokokken CAP | 33 (100) | 27 (100) | 25 (100) | |||
| met bekend serotype | ||||||
| PCV7 | 14 (42) | 6 (22) | 2 (8) | 0.52 (0.23-1.18) | 0.36 (0.08-1.62) | 0.19 (0.05-0.76) |
| PCV10extra | 6 (18) | 4 (15) | 4 (16) | 0.81 (0.26-2.6) | 1.08 (0.3-3.86) | 0.88 (0.28-2.79) |
| niet-PCV10 | 13 (39) | 17 (63) | 19 (76) | 1.6 (0.96-2.67) | 1.21 (0.84-1.74) | 1.93 (1.2-3.11) |
| niet-PCV7 | 19 (58) | 21 (78) | 23 (92) | 1.35 (0.95-1.93) | 1.18 (0.94-1.49) | 1.6 (1.17-2.19) |
Bij alle CAP- patiënten
In de PCV7-periode nam de proportie PCV7-serotypen af tot 4% (in vergelijking met 12% in de pre-PCV7-periode (RR 0.34 95% CI (Canadian Intense): 0.18-0.66)). Deze daling zette door in de PCV10-periode naar 1% (p<0.01). Er werden geen significante veranderingen gezien in PCV10extra-, niet-PCV7- en niet-PCV10- serotypeproporties tussen de 3 perioden.
Bij patiënten met een pneumokokken-CAP waarbij het serotype bekend is
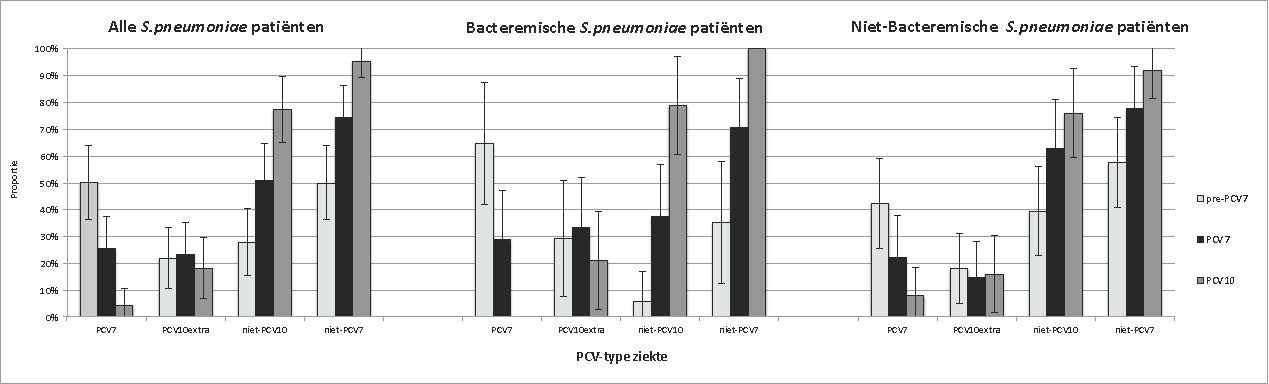
Ook binnen deze groep patiënten daalde de proportie PCV7-serotype CAP significant in de 2 periodes volgend op de pre-PCV7-periode. De PCV10-serotype proportie bleef statistisch gezien gelijk in de 3 periodes. Wanneer deze groep patiënten verder werd uitgesplitst naar patiënten met een bacteremische en met een niet-bacteremische pneumokokken-CAP, bleef de richting van de verschillen gelijk, maar waren ze relatief minder uitgesproken bij de patiënten met een niet-bacteremische pneumokokken-CAP (Figuur 2).
Figuur 2. Serotypeverdeling binnen alle pneumokokken-CAP-patiënten met een bekend serotype. Proporties van pneumokokken vergeleken tussen de perioden (pre-PCV7, PCV7 en PCV10). Balken zijn onderverdeeld in de verschillende serotypegroepen (PCV7-serotype, PCV10extra-serotype, niet-PCV7-serotype en niet-PCV10-serotype ziekte) . Foutbalken tonen het 95% betrouwbaarheidsinterval.
Discussie
De belangrijkste bevindingen van dit onderzoek zijn:
- In de 2 opvolgende perioden na de introductie van de pneumokokkenvaccinaties in het RVP is er een afname te zien van het aantal patiënten met een pneumokokken-CAP;
- Er is een significante afname te zien van het aantal patiënten met CAP veroorzaakt door 1 van de serotypes in PCV7; zowel bij patiënten met een bacteremische - als met een niet-bacteremische pneumokokken-CAP.
De afname van het aantal patiënten met een pneumokokken-CAP in de PCV7-periode ging gepaard met een toename van het aantal patiënten met een CAP veroorzaakte door atypische verwekkers. Dit kan verklaard worden door de Q-koortsepidemie en 2 uitbraken van psittacose. Desalniettemin bleef het aantal patiënten met een pneumokokken-CAP gelijk in de PCV10-periode, ook na verstrijken van de Q-koortsepidemie. Het aantal CAP-patiënten bij wie geen ziekteverwekker werd gevonden nam toe, terwijl de hoeveelheid uitgevoerde diagnostiek niet wezenlijk verschilde tussen de 3 perioden (supplement Tabel 1). Dit suggereert dat er sprake is van een aanhoudende afname van de proportie pneumokokken als ziekteverwekker bij patiënten opgenomen met een CAP.
Supplement Tabel 1. Ingezette diagnostiek en verschillen tussen testen gebruikt voor het identificeren van de verwekkers van CAP
| Pre-PCV7 2004-2006 | PCV7 2007-2009 | PCV10 2012-2016 | |
| (n=201) | (n=304) | (n=300) | |
| No. (%) | No. (%) | No. (%) | |
| Sputumkweek | 148 (74) | 143 (47) | 188 (63) |
| Sputum PCR a | 78 (39) | 91 (30) | 113 (38) |
| Urine antigeen L.pneumophila b | 186 (93) | 289 (95) | 287 (96) |
| Urine antigeen S.pneumoniae b | 183 (91) | 288 (95) | 287 (96) |
| Bloedkweek | 182 (90) | 259 (85) | 271 (90) |
| Conventionele serologie c | 130 (65) | 252 (83) | NA |
| Keelswab virale PCR d | NA | 225 (74) | 220 (73) |
| Keelswab atypische pathogenen e | NA | NA | 73 (24) |
| Virale kweek f | 88 (44) | NA | NA |
| Pneumokkenserologie g | 109 (54) | 169 (56) | 211 (70) |
Afkortingen: PCV7, 7-valente pneumokokken conjugaatvaccin; PCV10, 10-valente pneumokokken conjugaatvaccin; No.: aantal personen; a Sputum PCR voor atypische verwekkers: Legionella pneumophila, Mycoplasma pneumoniae en Chlamydophila pneumoniae/psittaci.b Urine antigeen testen voor de detectie van Legionella pneumophila serogroup 1 en Streptococcus pneumoniae (BinaxNOW®). c Gepaarde serologische testen (dag 1-3 en dag 10-21, respectievelijk) voor de detectie van antistoffen tegen Mycoplasma pneumoniae, Coxiella burnetii, Chlamydophila spp (species). of luchtweg virussen (adenovirus, influenza virus A en B, parainfluenza en respiratoir syncytieel virus).d Keelswab PCR voor virale verwekkers: (para)influenza, adenovirus, respiratoir syncytieel virus. e Keelswab PCR voor atypische verwekkers: Legionella pneumophila, Mycoplasma pneumoniae en Chlamydophila pneumoniae/psittaci.f Keelswab voor virale kweek: influenza.g Serotype-specifieke pneumokokkenantistoffen in serum werden getest voor de ontwikkeling van serotype-speciefieke pneumokokkenantistoffen door middel van specifieke titerstijgingen (14 serotypen).
De afname van het aantal patiënten met een CAP veroorzaakt door een van de serotypen in het PCV7 vanaf het begin van de pneumokokkenvaccinaties in het RVP, suggereert dat er bij volwassenen groepsimmuniteit is opgetreden. Werkhoven et al. toonde eerder vergelijkbare bevindingen in een Nederlands cohort, maar in deze studie was de observatieperiode, vanaf de invoering van PCV10 in het RVP, te kort om al PCV10-effecten aan te kunnen tonen.(6) Ook in onze studie zagen we - tot 6 jaar na de introductie van PCV10 in het RVP - geen duidelijke daling in het aantal patiënten met een niet-bacteremische pneumokokken-CAP veroorzaakt door een van de PCV10 extra-serotypen .
De kracht van dit onderzoek zit in het feit dat de resultaten voortkomen uit data van 3 goed omschreven cohorten die samenvallen met periodes kort vóór en na de invoering van de 2 pneumokokkenvaccinaties in het RVP. In alle cohorten werd uitgebreide conventionele microbiële diagnostiek verricht, wat is aangevuld met een serotypespecifieke immuno-assay om meer pneumokokkeninfecties, inclusief het infecterende serotype, te kunnen identificeren. Gezien het observationele karakter heeft dit onderzoek ook beperkingen. Verschillen in patiëntkarakteristieken tussen de cohorten kunnen invloed hebben gehad op de resultaten. Om aan te tonen dat het onwaarschijnlijk is dat het verschil in aantal patiënten met COPD in de voorgeschiedenis tussen de cohorten invloed heeft gehad, hebben we een sensitiviteitsanalyse uitgevoerd. Uitsluiting van deze patiënten uit de analyses leverde vergelijkbare resultaten op. Hetzelfde gold voor uitsluiting van alle patiënten die direct op een intensivecareafdeling waren opgenomen (alleen van toepassing op cohort 1).
Conclusie
Onze bevindingen suggereren dat pneumokokkenvaccinatie in het RVP geresulteerd heeft in groepsimmuniteit bij volwassen die opgenomen werden met een CAP. Dit blijkt uit een aanhoudende reductie van de proportie PCV7-serotypen na de introductie van PCV7 en PCV10. Daarnaast was er in de onderzochte populatie sprake van een reductie in de proportie pneumokkenziekte, zonder dat er een toename van andere pathogenen gezien werd. Deze gunstige neveneffecten vormen een extra argument om de pneumokokkenvaccinaties in het RVP te houden.
Dit artikel is eerder gepubliceerd in Vaccine [Internet]. 2017 Jul 24 [cited 2018 Feb 1];35(33):4112–8. http://www.ncbi.nlm.nih.gov/pubmed/28668570
Auteurs
G. H.J. Wagenvoort*1,2, S. M.T. Vestjens*3, B. J.M. Vlaminckx 1, E. M.W. van de Garde 4
*gelijkwaardige bijdrage
1. Afdeling Medische Microbiologie en Immunologie, St. Antonius Ziekenhuis, Utrecht/Nieuwegein
2 Laboratorium voor Medische Microbiologie en Infectieziekten, Isala, Zwolle
3. Afdeling Interne Geneeskunde, St. Antonius Ziekenhuis, Utrecht/Nieuwegein
4. Afdeling Klinische Farmacie, St. Antonius Ziekenhuis, Utrecht/Nieuwegein
Correspondentie
referenties
- Wagenvoort GHJ, Sanders EAM (Environmental Assessment Module), Vlaminckx BJ, Elberse KE, de Melker HE, van der Ende A, et al. Invasive pneumococcal disease: Clinical outcomes and patient characteristics 2–6 years after introduction of 7-valent pneumococcal conjugate vaccine compared to the pre-vaccine period, the Netherlands. Vaccine [Internet]. 2016 Feb 17 [cited 2017 May 29];34(8):1077–85. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26778420
- Knol MJ, Wagenvoort GHJ, Sanders EAM, Elberse K, Vlaminckx BJ, de Melker HE, et al. Invasive Pneumococcal Disease 3 Years after Introduction of 10-Valent Pneumococcal Conjugate Vaccine, the Netherlands. Emerg Infect Dis [Internet]. 2015 Nov [cited 2018 Mar 29];21(11):2040–4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26488415
- Vestjens SMT, Wagenvoort GHJ, Grutters JC, Meek B, Aldenkamp AF, Vlaminckx BJM, et al. Changes in pathogens and pneumococcal serotypes causing community-acquired pneumonia in The Netherlands. Vaccine [Internet]. 2017 Jul 24 [cited 2018 Feb 1];35(33):4112–8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/28668570
- Postma DF (dengue fever), van Werkhoven CH (Congenitale hypothyreoidie), van Elden LJR, Thijsen SFT, Hoepelman AIM, Kluytmans JAJW, et al. Antibiotic Treatment Strategies for Community-Acquired Pneumonia in Adults. N Engl J Med [Internet]. 2015 Apr 2 [cited 2018 Feb 1];372(14):1312–23. Available from: http://www.nejm.org/doi/10.1056/NEJMoa1406330
- Said MA, Johnson HL, Nonyane BAS, Deloria-Knoll M, O′Brien KL, Team for the AAPBS. Estimating the Burden of Pneumococcal Pneumonia among Adults: A Systematic Review and Meta-Analysis of Diagnostic Techniques. Hill PC, editor. PLoS (Plos One) One [Internet]. 2013 Apr 2 [cited 2018 Feb 2];8(4):e60273. Available from: http://dx.plos.org/10.1371/journal.pone.0060273
- van Werkhoven CH, Hollingsworth RC, Huijts SM, Bolkenbaas M, Webber C, Patterson S, et al. Pneumococcal conjugate vaccine herd effects on non-invasive pneumococcal pneumonia in elderly. Vaccine [Internet]. 2016 Jun 14 [cited 2018 Feb 1];34(28):3275–82. Available from: http://www.ncbi.nlm.nih.gov/pubmed/27171754
- Rodrigo C, Bewick T, Sheppard C, Greenwood S, Mckeever TM, Trotter CL, et al. Impact of infant 13-valent pneumococcal conjugate vaccine on serotypes in adult pneumonia. Eur Respir J [Internet]. 2015 Jun [cited 2018 Feb 1];45(6):1632–41. Available from: http://erj.ersjournals.com/lookup/doi/10.1183/09031936.00183614
- Endeman H, Schelfhout V, Paul Voorn G, van Velzen-Blad H, Grutters JC, Biesma DH. Clinical features predicting failure of pathogen identification in patients with community acquired pneumonia. Scand J Infect Dis [Internet].2008 Jan 8 [cited 2018 Feb 1];40(9):715–20. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19086245
- Meijvis SCA, Hardeman H, Remmelts HHF, Heijligenberg R, Rijkers GT, van Velzen-Blad H, et al. Dexamethasone and length of hospital stay in patients with community-acquired pneumonia: a randomised, double-blind, placebo-controlled trial. Lancet (London, England) [Internet]. 2011 Jun 11 [cited 2016 Dec 22];377(9782):2023–30. Available from: http://linkinghub.elsevier.com/retrieve/pii/S0140673611606077
- Registratie website https://clinicaltrials.gov/ct2/show/NCT01743755
- van Mens SP (Sustainable Procurement), Meijvis SCA, Endeman H, van Velzen-Blad H, Biesma DH, Grutters JC, et al. Longitudinal analysis of pneumococcal antibodies during community-acquired pneumonia reveals a much higher involvement of Streptococcus pneumoniae than estimated by conventional methods alone. Clin Vaccine Immunol [Internet]. 2011 May [cited 2018 Feb 1];18(5):796–801. Available from: http://cvi.asm.org/lookup/doi/10.1128/CVI.00007-11
- Fine MJ, Auble TE, Yealy DM (dystrophia myotonica), Hanusa BH, Weissfeld LA, Singer DE, et al. A prediction rule to identify low-risk patients with community-acquired pneumonia. N Engl J Med [Internet]. 1997 Jan 23 [cited 2016 Dec 22];336(4):243–50. Available from: http://www.nejm.org/doi/abs/10.1056/NEJM199701233360402
Infectieziekten Bulletin juni 2018
- Gesignaleerd
- Uitbraak van shigellose bij een studentenvereniging
- Een kwalijk luchtje in de werkomgeving
- Het gebruik van antibiotica binnen de Haagse verpleeghuiszorg: een bittere pil of niet…….?
- Veranderingen in pathogenen en pneumokokkenserotypen bij patiënten met een thuis opgelopen pneumonie
- Mijd de mijt
- Meldingen Wet publieke gezondheid tot en met week 20, 2018
- Meldingen uit de virologische weekstaten tot en met week 20, 2018
- Over Infectieziekten Bulletin