CPT (Commissie voor Praktische Tuberculosebestrijding) | richtlijnen diagnostiek | diagnostiek tuberculose-infectie | gepubliceerd 23 mei 2025
Inleiding
Deze richtlijn biedt een overzicht van de wetenschappelijke inzichten met betrekking tot de diagnostiek van infectie met Mycobacterium tuberculosis complex bij personen, die gescreend worden naar aanleiding van een reële kans op blootstelling, alsmede aanbevelingen voor de toepassing en de interpretatie van de diagnostische testen. De richtlijn is bedoeld voor artsen die betrokken zijn bij de diagnostiek van tuberculose-infectie (TBI), zoals artsen werkzaam op een tuberculoseafdeling van een GGD (Gemeentelijke Gezondheidsdienst), longartsen, internisten, kinderartsen, arts-microbiologen, bedrijfsartsen, huisartsen en mogelijk andere specialisten. De richtlijn bespreekt niet de TBI ( Tuberculose-infectie)-diagnostiek bij personen met immuunsuppressieve medicatie of met ziekten die de cellulaire immuniteit verminderen (zie Tabel 1).
Daarvoor wordt verwezen naar specifieke richtlijnen zoals de FMS-richtlijn Tuberculosescreening voorafgaand aan immuunsuppressieve medicatie en de CPT-richtlijn Tuberculose-HIV. Zie ook de Vragenlijst Tuberculoseonderzoek.
Tabel 1 Aandoeningen of condities met een verhoogde kans op progressie naar tuberculose indien geïnfecteerd met M. tuberculosis complex. Bron: Erkens 2010
Aanbeveling
Als er een indicatie is om TBI ( Tuberculose-infectie)-diagnostiek te doen (bijvoorbeeld na contact met een patiënt met infectieuze longtuberculose) bij personen die al met immunosuppressieve medicatie worden behandeld, is primaire profylaxe te adviseren, dus zonder vooraf te testen, vanwege een grotere kans op fout-negatieve testen bij deze personen. (Niveau 4)
Wat is een tbc-infectie (TBI)?
Overwegingen
Infectie met M. tuberculosis complex veroorzaakt een complexe immuunrespons van alveolaire macrofagen en T-cellen op geïnhaleerde tuberkelbacteriën (Getahun 2015). Bij de meeste individuen leidt deze respons tot het controleren of het klaren van de infectie en een langdurige sensibilisatie van T-cellen tegen M. tuberculosis antigenen (Russell 2001, Tufariello 2003, Mack 2009). Wanneer de bacterie geremd, maar niet geklaard wordt en in de macrofagen weet te persisteren, is er sprake van een tbc (Tuberculose)-infectie (TBI). De persisterende bacteriën kunnen zich vermeerderen en binnen macrofagen versleept worden in het lichaam, en vroeger of later aanleiding geven tot de ziekte tuberculose. Het risico op ziekte is het hoogst in de eerste twee jaar na infectie en neemt daarna af. Afhankelijk van de individuele gevoeligheid, bepaald door leeftijd en co-morbiditeit en het tijdstip dat getest wordt, ontwikkelt zich bij 1-15% van de geïnfecteerden primaire tuberculose. Bij circa 4% van de geïnfecteerden ontwikkelt tuberculose zich langer dan twee jaar na infectie en wordt post-primaire tuberculose genoemd (Comstock 1974, Borgdorff 2011). De kans op ontwikkeling van tuberculose is dus afhankelijk van de tijd die is verstreken sinds het moment van infectie.
Er bestaat geen (immunologische) test waarmee de aanwezigheid van levende bacteriën kan worden aangetoond. Het onderscheid tussen personen bij wie het immuunsysteem de groei van de bacteriën remt, of bij wie geen levende bacteriën meer in het lichaam aanwezig zijn (clearance of infection), kan niet gemaakt worden. Er is dus geen gouden standaard om TBI ( Tuberculose-infectie) vast te stellen. TBI wordt daarom vaak gedefinieerd als de aanwezigheid van een cellulaire immuunrespons tegen M. tuberculosis complex, bij een persoon zonder klinische, bacteriologische of radiologische aanwijzingen voor actieve tuberculose (Mack 2009). Ook patiënten die in het verleden tuberculose hebben doorgemaakt, en hiervoor adequaat zijn behandeld, vertonen vaak nog een cellulaire immuunrespons. In dit geval wordt niet van een TBI gesproken. Daarnaast sluiten negatieve bevindingen TBI niet uit, omdat de testresultaten fout-negatief kunnen zijn.
De diagnose TBI is dus altijd een waarschijnlijkheidsdiagnose gebaseerd op:
- positieve tuberculinehuidtest (THT), positieve tbc-antigeen huidtest en/of interferon-gamma release assay (IGRA), of
- aanwijzingen voor expositie aan tuberculose in de anamnese, of
- aanwijzingen voor doorgemaakte en onbehandelde (primaire) tuberculose,
en
- geen aanwijzingen voor actieve tuberculose bij anamnese, lichamelijk onderzoek en röntgenonderzoek (thoraxfoto)
De diagnostiek van TBI vereist een deskundige oordeelsvorming omtrent de bevindingen, met name wanneer de patiënt immuungecompromitteerd is of gaat starten met immuunsuppressieve therapie.
De diagnostiek van TBI vereist verder inzicht in:
- de epidemiologie van tuberculose;
- de risico-inschatting op het ontwikkelen van tuberculose van de individuele patiënt in relatie tot de mate van expositie;
- de sensitiviteit, specificiteit en voorspellende waarde van de beschikbare testen.
In landen met een lage tbc-incidentie zoals Nederland is de tbc-bestrijding naast het opsporen en behandelen van tuberculose ook gericht op het opsporen en behandelen van (latente) tbc-infecties. Voorheen werd hiervoor de afkorting LTBI (latente tuberculose infectie) gebruikt. Sinds 2022 is het woord latent internationaal verlaten en wordt ook in Nederland de afkorting TBI gebruikt. Met screening op TBI wordt beoogd zowel nieuwe gevallen van tuberculose als verdere transmissie te voorkomen. De screening op TBI dient hiermee zowel een individueel belang (het voorkomen van actieve tuberculose) als een volksgezondheidsbelang (het voorkomen van nieuwe besmettelijke bronnen en verdere verspreiding van tuberculose). Het individuele belang staat voorop: de voordelen voor het individu dienen op te wegen tegen de nadelen en dienen te allen tijde zorgvuldig te worden afgewogen (WHO 2017).
Wie zijn de doelgroepen voor screening op TBI?
Doelgroepen TBI ( Tuberculose-infectie)-screening
- Personen met recente blootstelling (bron- en contactonderzoek)
- Personen met een verhoogd risico op het ontwikkelen van ziekte indien geïnfecteerd, zoals
- Personen met hiv (Humaan Immunodeficientievirus)
- Patiënten die behandeld worden met immuunsuppressieve medicatie
- Personen met verhoogd risico op blootstelling en daardoor grotere kans op een TBI, zoals
- Asielzoekers en immigranten
- Reizigers
Beschrijving van de indicaties van TBI ( Tuberculose-infectie)-onderzoek bij personen met recente blootstelling aan M. tuberculosis worden gegeven in de CPT-richtlijn Bron- en contactonderzoek (2020).
Adviezen ten aanzien van screening van personen met een hoge kans op ontwikkelen van tuberculose indien geïnfecteerd (klinische doelgroepen) staan in:
- CPT-richtlijn Tuberculose-HIV (2020)
- FMS-richtlijn Tuberculosescreening voorafgaand aan immuunsuppressieve medicatie
De overige (niet-klinische) doelgroepen voor het screenen op TBI zijn beschreven in verschillende andere CPT-richtlijnen gericht op de preventie van tuberculose, zoals:
- Beleid screening asielzoekers en immigranten (2019)
- Richtlijn Reizigers naar tbc-endemische gebieden (2020)
- Tuberculosescreeningsbeleid ziekenhuismedewerkers (2022)
- Tuberculosescreeningsbeleid contactgroepen ander dan ziekenhuismedewerkers (2020)
- Screening van drugsverslaafden, dak- en thuislozen, illegalen en passanten (2015)
Screening op TBI heeft géén toegevoegde waarde:
- Bij immuuncompetente personen met een lage kans op infectie. Bij deze personen is de kans dat een positieve uitslag fout-positief is groot.
- Voor de monitoring van therapie bij tuberculose of TBI.
- Bij personen bij wie in het verleden tuberculose of TBI is aangetoond.
Welke testen zijn beschikbaar om de diagnose TBI te stellen?
Overwegingen
De immuunrespons tegen M. tuberculosis complex kan in vivo indirect gemeten worden met een tuberculinehuidtest (THT of Mantouxtest) of een tbc (Tuberculose)-antigeen huidtest of ex vivo met een interferon-gamma release assay (IGRA). De in Nederland geregistreerde testen zijn:
- PPD Tuberculinehuidtesten: Tuberculine PPD RT23 SSI 2 TE, oplossing voor injectie 2 TE/0,1 ml (AJ Vaccines, Kopenhagen, Denemarken)
- Tbc-antigeen huidtesten: Siiltibcy® (Serum Institute India, Hadapsar, India), eerder heette deze test Cy-Tb en C-Tb.
- Interferon-gamma release assays (IGRAs): T-SPOT.TB®assay (T-SPOT; Oxford Immunotec, Verenigde Koninkrijk) en QuantiFERON-TB Gold Plus® (QFT-Plus; Qiagen, Hilden, Duitsland).
1
De tuberculinehuidtest (THT of Mantoux) is de meest gebruikte test voor het vaststellen van infectie met M. tuberculosis. De potentiële diagnostische waarde van tuberculine, een mengsel van antigenen gemaakt uit een kweekfiltraat van M. tuberculosis, werd in 1907 door Von Pirquet ontdekt. Het jaar erop introduceerde Mantoux de intradermale techniek, die nog steeds wordt gebruikt (Verbon 2003). In 1941 ontwikkelden Seibert en Glenn het zogenoemde ‘purified protein derivative’ (PPD)-S, dat nog steeds het referentiemateriaal is voor standaardisering van andere tuberculinen. PPD-RT23, ontwikkeld door het SSI in Kopenhagen, is geaccepteerd en gestandaardiseerd door de WHO (World Health Organization) (Comstock 1964, Bleiker 1990); 0,1 ml bevat 2 Tuberculine Eenheden (TE). PPD-RT23 SSI wordt sinds 2018 geproduceerd door de firma AJ Vaccines en is geregistreerd voor gebruik in Nederland (RVG 17662).
De THT (Tuberculinehuidtest) meet de mate van overgevoeligheid van het vertraagde type (type IV (Informatievoorziening) volgens Gell en Coombs) voor een mengsel van antigenen van M. tuberculosis. Bij de test volgens Mantoux wordt 0,1 ml tuberculine intracutaan toegediend op de strekzijde van de onderarm. Wanneer een persoon cellulaire immuniteit heeft opgebouwd tegen de tuberculineantigenen, zal binnen 48-72 uur een celgemedieerde reactie optreden (Verbon 2003). Deze reactie zorgt voor lokale zwelling en komt tot uiting door een induratie op de injectieplaats. De reactie wordt idealiter na 48 tot 72 uur afgelezen als grootste transversale diameter van de induratie en uitgedrukt in millimeters in één richting, dwars op de onderarm. Een reactie die langer dan 72 uur nog groter is dan het afkappunt kan als positief worden beschouwd. De THT dient door bekwaam personeel te worden uitgevoerd (zie werkinstructie). Ook bij geheel correcte uitvoering moet met afleesvariatie rekening worden gehouden (Menzies 2000a). Het verschil dient tussen verschillende aflezers gemiddeld niet meer dan 2 mm te bedragen (Guld 1958).
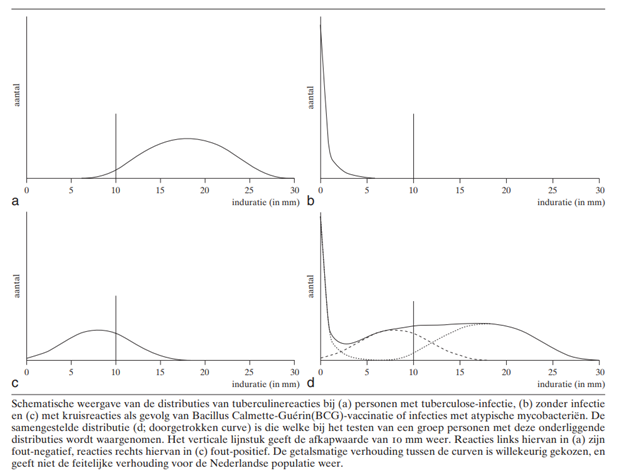
Figuur 1 Schematische weergave van de distributies van tuberculinereacties. Overgenomen uit Verbon (2003), met toestemming NTvG (Nederlands Tijdschrift voor Geneeskunde).
Sensitiviteit en anergie
In een met M. tuberculosis-geïnfecteerde populatie vertonen de reacties op de tuberculinehuidtest een normale verdeling met de top tussen 16 en 20 mm (figuur a). Bij een afkapwaarde van 10 mm is de sensitiviteit ongeveer 95%, maar deze kan verlaagd zijn door anergie (Steiner 1980) dat wil zeggen verminderd vermogen om een type-IV overgevoeligheidsreactie te ontwikkelen. Deze anergie is vaak absoluut: de reactie is niet minder, maar geheel afwezig (Menzies 2000a). Twee tot 5 procent van immuuncompetente volwassenen en 14% van kinderen met een bacteriologisch bevestigde tuberculose vertoont geen huidreactie na THT. Tabel 2 beschrijft de verschillende oorzaken van anergie of fout-negatieve reacties.
| Aandoening of conditie |
|---|
| Leeftijd jonger dan 6 maanden |
| Leeftijd 65 jaar en ouder (Woodruff 1971) |
| Cellulaire immuun suppressie (hiv, aids, CD4 (cluster of differentiation 4) count <200) (Cobelens 2006) |
| Acute of recente ernstige virale infecties (rubella, mazelen, mononucleose (M. Pfeifer)) (Mori 1985, Tamashiro 1987, Bentzon 1953, Weiss 1953) |
| Andere bacteriële infecties (kinkhoest, lepra, roodvonk, buiktyfus, paratyfus, brucellose) (Bentzon 1953) |
| Recente immunisatie (<6 weken) met levend vaccin (bof, mazelen, rubella, gele koorts) (Brody 1964, Mellman 1963). Het is onwaarschijnlijk dat een oraal vaccin, zoals het rotavirusvaccin, een systemisch immuunsuppressief effect heeft op de THT. |
| Ernstige verzwakkende ziekte (maligniteit, nierfalen / uremie, chronische lymfatische leukemie, fysieke stress, operaties, brandwonden) (Hughes 1965, Wessels 1992) |
| Hoge dosis corticosteroïden (>15 mg prednisolon equivalent) (Belard 2011), TNF-alfa (Tumor necrose factor alfa) remmers of behandeling met andere immunosuppressiva |
| Vergevorderde longtuberculose, tuberculose van het centraal zenuwstel of miliaire tuberculose (Rooney 1976, Christie 2008) |
| Sarcoïdose (Smith-Rohrberg 2006) |
| Ondervoeding (Pelly 2005) |
| Zeer recente besmetting; periode voor manifeste immuunrespons M. tuberculosis complex |
| Test gebonden oorzaken |
| Toedieningsfouten (te weinig of te diep) |
| Afleesfouten (onervaren, onzorgvuldig, te vroeg, te laat) |
| Onjuist bewaren van de testvloeistof |
| Contaminatie of chemische denaturatie van de testvloeistof |
| Administratieve fouten bij handmatig verwerken resultaten |
Specificiteit
In een niet met M. tuberculosis-geïnfecteerde populatie lopen de tuberculinereacties uiteen van 0 tot 5 mm (figuur b). In veel populaties, waaronder de Nederlandse, is er een tweede, normale verdeling waarvan de piek tussen de 5 en 10 mm ligt (figuur c) (Palmer 1953). Deze reacties zijn het gevolg van een kruisreactie met non-tuberculose mycobacteriën (NTM, vroeger ook wel atypische mycobacteriën genoemd) of eerdere vaccinatie met Bacillus Calmette-Guérin (BCG) (Guld 1957, Edwards 1969). De specificiteit van de TST hangt bij een gegeven afkapwaarde daardoor mede af van de prevalentie van infecties met NTM (nontuberculeuze mycobacteriën) en van de BCG (Bacillus Calmette-Guérin)-vaccinatiegraad en de duur verstreken na de BCG-vaccinatie (zie figuur d). Infecties met NTM blijven doorgaans asymptomatisch, tenzij er afweerstoornissen in het spel zijn. De infectiegraad met NTM kent sterke geografische variaties (Edwards 1969), zodat specificiteit tussen populaties kan verschillen. De tuberculinerespons door infecties met NTM neemt sneller af dan die door infecties met M. tuberculosis en deze afname komt ook op jonge leeftijd en bij goede immuniteit voor (Menzies 2000b). Hetzelfde geldt voor de tuberculineovergevoeligheid door BCG-vaccinatie: hoewel vrijwel iedereen binnen 2 maanden na vaccinatie een positieve testuitslag heeft, neemt de reactie met de tijd af. Bij jonge kinderen kan dat enkele jaren duren (Joos 2006, Chen 2012). Vrijwel alle kinderen die in het eerste levensjaar zijn gevaccineerd, hebben 10 jaar later een negatieve tuberculinereactie, terwijl na vaccinatie op latere leeftijd tot 21% langer dan 10 jaar positief blijft (Menzies 1999, Menzies 2000b, Farhat 2006).
Conversie, reversie, waning en boosting
De volgende begrippen worden gehanteerd om de fysiologische variabiliteit van testen weer te geven voor het vaststellen van vertraagde cellulaire hypersensitiviteit tegen specifieke mycobacteriële antigenen:
- Conversie: De eerste manifestatie van een vertraagde cellulaire reactie.
- Reversie: Het in omvang afnemen tot onder het afkappunt van een eerder vastgestelde positieve reactie door ‘waning’ ofwel fysiologisch verlies van tuberculineovergevoeligheid.
- Boosting: Toename van de reactie als gevolg van stimulatie van het cellulaire immuungeheugen door eerder toegediend tuberculine.
De periode tussen het moment van infectie en de conversie, de zogenoemde ‘window periode’ varieert. Experimentele en epidemiologische studies hebben aangetoond dat THT-conversie optreedt binnen 8 weken na expositie (Menzies 1999). Dit houdt dus in dat kort na een opgelopen M. tuberculosis infectie de THT nog negatief kan zijn, maar dat deze indien hij 8 weken later herhaald wordt, positief zal zijn.
Studies naar seriële testen met tuberculine hebben aangetoond dat de tuberculinereactie kan afnemen en reversie en boosting kunnen optreden (Houk 1968, Hsu 1983; Felten 1989, Menzies 1999). Het betrof meestal een reductie van de reactie van enige millimeters en geen totale reversie. Reversie komt vaker voor bij reacties tussen de 5 en 14 mm en bij mensen bij wie er sprake was van een aangetoond booster fenomeen (Grzybowski 1964, Gordin 1991).
Het waning-fenomeen vormt een oorzaak van verminderde sensitiviteit bij oudere volwassenen (Woodruff 1971, Stead 1987). Als het T-cel geheugen is afgenomen kunnen personen met een TBI ( Tuberculose-infectie) een negatieve testuitslag bij een eerste THT hebben. Deze leeftijdsafhankelijke afname komt voor vanaf het 50e levensjaar. Onder geriatrische patiënten in België werd de mate van waning geschat op 24-34% voor 65- tot 74-jarigen en op 39-56% voor 75-84-jarigen (Van den Brande 1992).
Waning van de tuberculinehuidtest kan middels een ‘initiële 2-stapsprocedure’ worden uitgesloten. Door de eerste tuberculinehuidtest wordt de immuunrespons opgepept (‘geboost’). Daaropvolgende THT’s en/of IGRA (interferon-gamma release assay)’s kunnen dan een positieve uitslag geven. Op deze wijze kan een in het verleden opgelopen infectie aangetoond worden (Menzies 1999, Leyten 2007, Van Zyl-Smit 2009).
Het boostingfenomeen is het sterkst 1-5 weken na de eerste test, maar kan tot een jaar erna aanhouden (Menzies 1999). Boosting treedt uitsluitend op indien bestaande tuberculinegevoeligheid in de loop van de tijd door reversie of waning is afgenomen, en niet door het testen met tuberculine alleen. Het kan optreden bij gevoeligheid na infectie met M. tuberculosis, maar ook met NTM of na BCG-vaccinatie. Van de BCG-gevaccineerden met een initieel negatieve testuitslag heeft 10-25% als gevolg van boosting een positieve reactie bij de herhalingstest (Menzies 2000b).
2
Sinds het verschijnen van de vorige versie van deze richtlijn zijn er een aantal studies gedaan die de waarde van het gebruik van tbc (Tuberculose)-specifieke antigeen huidtesten hebben onderzocht. Deels werd vergeleken met de THT (Tuberculinehuidtest) en/of IGRA (interferon-gamma release assay), echter deels zonder vergelijking. Vaak werd, bij ontbreken van een gouden standaard voor tbc-infectie, de sensitiviteit onderzocht bij patiënten met actieve tuberculose. De specificiteit werd onderzocht in laag-risico populaties.
De WHO (World Health Organization) heeft in 2022 de tbc-antigeenhuidtesten voor het eerst opgenomen in een van hun richtlijnen. Daarnaast is er in hetzelfde jaar een systematische review, inclusief een meta-analyse waar mogelijk, verschenen in een peer-reviewed tijdschrift (Krutikov 2022). De WHO-richtlijn en de studie van Krutikov overlappen gedeeltelijk in de selectie van artikelen en hun doelstellingen. De WHO-richtlijn richt zich op drie verschillende tbc-antigeen huidtesten, afkomstig uit Rusland, China en India (waarbij het product uit India is ontwikkeld door SSI in Denemarken). Het artikel van Krutikov et al. bespreekt ook een vierde tbc-antigeen huidtest uit de Verenigde Staten. De conclusies van beiden komen overeen: tbc-antigeen huidtesten lijken qua testkarakteristieken, zoals sensitiviteit en specificiteit, overeen te komen met de IGRA. Vergeleken met de THT waren de tbc-antigeen huidtesten specifieker, hoewel dit afhangt van de gebruikte afkapwaarde voor de THT. Dit is consistent met eerdere studies die de THT met de IGRA vergeleken. De veiligheid van de tbc-antigeen huidtesten lijkt vergelijkbaar met die van de THT. Er lijken geen significante verschillen te zijn tussen de verschillende tbc-antigeen huidtesten. Echter, er was een aanzienlijke heterogeniteit tussen de studies, onder andere in de keuze van de criteria voor een positieve tbc-antigeen huidtest. Bovendien was er een aanzienlijk risico op bias, dat varieerde voor de verschillende huidtesten.
De in Denemarken ontwikkelde tbc-antigeen huidtest, die door een bedrijf in India op de Europese markt wordt geïntroduceerd, heeft de naam Siiltibcy gekregen (voorheen bekend als C-Tb of Cy-Tb). De test is positief beoordeeld door het Europees Geneesmiddelenbureau (EMA) en goedgekeurd door de Europese Commissie. In Nederland wordt de test geleverd door Bilthoven Biologicals, een dochteronderneming van het Indiase Serum Instituut India. Een samenvatting van de productkenmerken (SmPC) van de test is beschikbaar in verschillende talen.
Siiltibcy bevat twee recombinante M. tuberculosis-specifieke antigenen, rdESAT-6 en rCFP-10. In geval van infectie met M. tuberculosis induceert Siiltibcy een vertraagde overgevoeligheidsreactie door de specifieke antigenen in Siiltibcy. Deze reactie wordt gezien als een induratie op de injectieplaats. De induratie bereikt zijn maximum 48 tot 72 uur na toediening.
Het veiligheidsprofiel is gebaseerd op gegevens uit klinische onderzoeken waarbij Siiltibcy werd toegediend aan 2960 proefpersonen, variërend in leeftijd van 32 dagen tot 76 jaar. De meest voorkomende bijwerkingen waren jeuk op de injectieplaats (20%), pijn op de injectieplaats (8%) en een hematoom op de injectieplaats (6%).
Sensitiviteit
In Spanje werd de C-Tb vergeleken met de THT en Quantiferon-TB-Gold (QFT) in vier risicogroepen (negatieve controle, incidentele contacten, nauwe contacten en positieve controle) (Ruhwald 2017). Er werd een sterk positieve trend waargenomen voor C-Tb: 3%, 16%, 43% en 67% respectievelijk voor de vier risicogroepen; dit gold ook voor de andere twee tests. De C-Tb was minder vaak positief: 67% in de positieve controlegroep, bestaande uit 101 personen met bacteriologisch bewezen tuberculose, vergeleken met de THT (81%) en QFT (90%). Het verschil met QFT was significant.
In Zuid-Afrika werden testresultaten van 1090 proefpersonen met een vermoeden van tuberculose vergeleken met een controlegroep van 100 gezonde kinderen van 5 tot 11 jaar (Aggerbeck 2018). Van de 75 personen (45% met hiv (Humaan Immunodeficientievirus)) met microbiologisch bewezen tuberculose was de sensitiviteit van C-Tb, THT en QFT respectievelijk 72%, 75% en 73%. Opmerkelijk was het hoge percentage ‘indeterminate’ QFT-resultaten (20%) die niet in de sensitiviteit werden meegenomen; als ze wel meegeteld waren, zou de sensitiviteit van QFT 59% zijn. In de groep gezonde kinderen was de C-Tb, THT en QFT positief in respectievelijk 17%, 15% en 23% van de deelnemers.
In een derde studie, ook in Zuid-Afrika, werd de omvang van de huidreacties van C-Tb en THT vergeleken bij 456 personen met tuberculose die niet of korter dan twee weken met tuberculostatica werden behandeld (Aggerbeck 2018). De sensitiviteit van C-Tb en THT was respectievelijk 78% en 83%, zonder significant verschil. De QFT was positief bij 69% van de personen die met deze test werden onderzocht. Ook hier was er een hoog percentage (19%) ‘indeterminate’ resultaten. Als deze niet in de berekening werden meegenomen, was de sensitiviteit 86%.
De fabrikant heeft in een post-hoc analyse de sensitiviteit berekend op basis van de volledige dataset van de populatie met bevestigde tuberculose (zie SmPC).
Specificiteit
In een fase 2-onderzoek met 151 BCG (Bacillus Calmette-Guérin)-gevaccineerde personen werd de specificiteit van C-Tb onderzocht. Alle deelnemers werden vooraf getest met QFT, waarvan de resultaten negatief waren. De C-Tb had een specificiteit van 99%, terwijl de THT/PPD een specificiteit van 63% vertoonde bij een afkappunt van 5 mm en 92% bij een afkappunt van 15 mm (Aggerbeck 2013). In een studie met 263 negatieve controles (studenten en personeel van Spaanse universiteiten) bleek 96% een negatieve C-Tb te hebben, 96% een negatieve QFT en 78% een negatieve THT (Ruhwald 2017).
De fabrikant heeft in een post-hoc analyse de specificiteit berekend op basis van de volledige dataset van de negatieve controlegroep (zie SmPC).
Enkele belangrijke eigenschappen van de test zijn (uit de productinformatie, SmPC):
- 0,1 ml Siiltibcy wordt geïnjecteerd in de huid (intradermaal) van het bovenste deel van de onderarm volgens de Mantoux-techniek, waarna er een papel ontstaat die na ongeveer 10 minuten verdwijnt.
- Vanuit microbiologisch oogpunt kan het product, eenmaal geopend, maximaal 28 dagen worden bewaard bij 2 °C tot 8 °C.
- De induratie (verharding) moet na 48 tot 72 uur gemeten worden door een getrainde gezondheidswerker.
- De test kan fout-negatief zijn als de blootstelling korter is geweest dan 6 tot 8 weken voor blootstelling aan M. tuberculosis.
- De veiligheid en werkzaamheid van Siiltibcy bij pasgeborenen jonger dan 28 dagen zijn niet bekend. De test wordt niet geïndiceerd voor deze neonaten.
- De fabrikant adviseert om een test interval aan te houden van minimaal 6 weken.
- Zie SmPC voor contra-indicaties, interacties en bijwerkingen. De meest voorkomende bijwerkingen zijn: pijn op de injectieplaats, jeuk en hematoom.
- Anafylactische of andere allergische reacties zijn mogelijk na toediening van Siiltibcy.
3
Een IGRA (interferon-gamma release assay) meet de in vitro respons van T-cellen op specifieke antigenen van M. tuberculosis, welke niet voorkomen in M. bovis BCG (Bacillus Calmette-Guérin). T-cel responsen op deze antigenen zijn een betrouwbare aanwijzing voor infectie met M. tuberculosis, maar noch een kwalitatieve positieve IGRA-uitslag noch het kwantitatieve testresultaat differentieert tussen actieve tuberculose en tuberculose infectie (TBI). De IGRA’s kunnen derhalve de bestaande diagnostiek voor actieve tuberculose niet vervangen.
De antigenen in de commercieel verkrijgbare IGRA-testen bestaan uit peptiden van ESAT-6 en CFP-10. De NVMM-richtlijn Mycobacteriële Laboratoriumdiagnostiek beschrijft de operationele aspecten van deze testen in detail. Beide testen hebben een positieve (mitogeen) en negatieve controle (nil). Wanneer de uitslag van een van de controles afwijkend is, wordt een ‘indeterminate’ uitslag afgegeven. De NVMM beveelt aan bij een indeterminate uitslag bij een immuuncompetente persoon de test éénmaal te herhalen met een nieuw bloedmonster om uit te sluiten dat externe factoren invloed hebben gehad op de indeterminate uitslag.
QFT-Plus is een nieuwe generatie van QFT-GIT welke een additionele antigeen buis heeft (TB2). De TB1 buis bevat ESAT-6- en CFP-10-gederiveerde peptiden gericht op het opwekken van een celgemedieerde immuunrespons van CD4 (cluster of differentiation 4)+ T-helper lymfocyten. TB2 bevat naast dezelfde peptiden als in de TB1-buis nog additionele peptiden welke interferon-gamma productie zouden stimuleren van CD8+ T-cellen. Volgens een studie waarin QFT-GIT en QFT-Plus werden vergeleken (Barcellini 2016), heeft QFT-Plus een sterkere associatie met recente expositie aan tuberculose dan QFT-GIT in volwassen tbc (Tuberculose)-contacten die gescreend werden voor TBI ( Tuberculose-infectie). Een studie onder 989 gezondheidswerkers in de V.S. liet echter zien dat de overgrote meerderheid van discordante TB1- en TB2-resultaten in de range van 0,2 tot 0,7 IU/ml vielen en bij follow up QFT negatief bleken in 90% (Moon 2017).
QuantiFERON®-Plus (QFT-Plus) en (QFT-GIT) werden in de Lowlands studie vergeleken in 16 laboratoria in Nederland en België. Analyse van 1031 QFT testen toonde 95% overeenkomst. Recent blootgestelde personen hadden significant vaker een verschil tussen TB1 en TB2 in de QFT-Plus. De hoeveelheid discordante resultaten met alleen positieve QFT-Plus (19/1031) en alleen positieve QFT-GIT (22/1031) waren vergelijkbaar (Pieterman 2018). De werkgroep concludeert dat bij discordantie van de uitslagen TB1 en TB2 in de QFT-Plus de test als positief beschouwd moet worden, zoals wordt aanbevolen door de fabrikant. Echter als de waarde met positieve uitslag hoog is (bijvoorbeeld >2,0), en de andere negatief kan worden overwogen dat er sprake is van een laboratoriumfout en is het zinvol de test te herhalen.
De QFT-Plus is logistiek eenvoudiger, maar de T-SPOT.TB is minder afhankelijk van het aantal witte bloedcellen per ml bloed (Pai 2006).
Sensitiviteit en specificiteit
Er is geen gouden standaard om de sensitiviteit en de specificiteit van de THT (Tuberculinehuidtest) en IGRA voor TBI vast te stellen. Voor het bepalen van de sensitiviteit van TBI-testen wordt daarom het vermogen om een positieve reactie vast te stellen bij personen met kweekpositieve tuberculose. Voor het bepalen van de specificiteit wordt het vermogen om een negatieve test vast te stellen bij personen met een laag risico op tbc-expositie uit laag-endemische settings als surrogaat gebruikt.
De specificiteit van IGRA hangt samen met het gebruik van zeer specifieke antigenen van M. tuberculosis, die afwezig zijn in BCG en in de meeste atypische mycobacteriën (NTM) uitgezonderd M. kansasii, M. marinum, M. flavescens, M. szulgai, M. leprae, en enkele zeldzaam voorkomende NTM (nontuberculeuze mycobacteriën) (Harboe 1996, Andersen 2000, Arend 2002, Arend 2005).
Systematische reviews hebben aangetoond dat de sensitiviteit van de IGRA (Quantiferon-GIT tussen 0,78 en 0,81; T Spot.TB tussen 0,81 en 0,90) niet veel verschilt met de THT (0,70-0,77) Sollai 2014). De T-SPOT.TB lijkt bij volwassenen een betere sensitiviteit te hebben dan de QuantiFERON testen en de THT (Pai 2014). De specificiteit van de IGRA is wel duidelijk hoger (0,82-0,99 voor Quantiferon-GIT en 0,82-0,93 voor de T Spot.TB) dan die van de THT (circa 0,60).
Voor de ontwikkeling van de ‘WHO guidelines for TB (tuberculose) infection (WHO 2014, WHO (World Health Organization) 2020) is een systematische review uitgevoerd naar de voorspellende waarde van de THT en IGRA voor het ontwikkelen van tuberculose. In deze studies werd een afkappunt van 10 mm voor de THT gehanteerd. De pooled risk ratio schatting voor THT was 2,64 (95% CI (Canadian Intense): 2,04–3,43, n=22 studies) en voor IGRA 8,45 (95% CI: 4,13–17,31, n=16 studies). Voor landen met een tbc-incidentie van minder dan 100 per 100.000 was de pooled risk ratio’ voor IGRA nog iets hoger: 13,55 (95% CI: 6,08–30,21). Echter, in de head-to-head vergelijking van 8 studies waarin zowel de THT en IGRA werd verricht was de pooled risk ratio schatting van THT 2,58 (95% CI: 1,72–3,88) en van IGRA 4,94 (95% CI: 1,79–13,65). Gebaseerd op deze resultaten stelt de WHO vast dat er onvoldoende aanwijzingen zijn om in hoogendemische landen de IGRA boven de THT te prefereren. De WHO stelt vast dat de beschikbaarheid van de testen en praktische overwegingen kunnen bepalen aan welke test de voorkeur wordt gegeven.
Conversie, reversie, boosting en reproduceerbaarheid
Er is beperkt wetenschappelijk bewijs voor de duur van de periode voor conversie van IGRA na infectie met M. tuberculosis. Enkele studies concluderen dat de meeste IGRA-conversies optreden binnen 4 tot 7 weken na exposite aan tuberculose (Arend 2008, Bergamini 2009, Anibarro 2011, Lee 2011). In sommige gevallen treedt een conversie zelfs later dan 3 maanden op: de overeenkomst tussen THT en IGRA vertoont een hogere concordantie na deze (3 maanden) periode. Om er zeker van te zijn dat de IGRA een recent opgelopen infectie aan zal aantonen, wordt voorlopig als leidraad aanbevolen minimaal 8 weken na de laatste expositie te testen, dezelfde tijd die staat voor de window-periode van de THT.
IGRA wordt ex vivo verricht, dus de testuitslag kan niet worden beïnvloed door een voorgaande IGRA. Echter, er kan wel een boosterfenomeen van THT op de IGRA optreden als het interval tussen het zetten van de THT en het afnemen van de IGRA meer dan 3 dagen is (Leyten 2007, Van Zyl-Smit 2009).
Verscheidene studies rapporteren variabiliteit van IGRA, wanneer de test wordt herhaald (Veerapathran 2008, van Zyl-Smit 2009, Whitworth 2012, Metcalfe 2013, Sollai 2014). De achtergronden van de soorten van variabiliteit zijn uitgebreid beschreven in de NVMM richtlijn Mycobacteriële Laboratoriumdiagnostiek.
Interpretatie van de testuitslagen
Aanbevelingen
- Bij THT (Tuberculinehuidtest) ≥5 of ≥10 mm (afhankelijk van de voorafkans op recente infectie met M. tuberculosis), positieve tbc (Tuberculose)-antigeen huidtest (≥5 mm) of positieve IGRA (interferon-gamma release assay) moet actieve tuberculose uitgesloten worden alvorens de diagnose TBI ( Tuberculose-infectie) gesteld kan worden (Niveau 2).
- Bij een lage voorafkans op recente infectie met M. tuberculosis (verwachte prevalentie <10%) is het zinvol een positieve THT-reactie (≥5 mm of ≥10 mm) te bevestigen met een IGRA (Niveau 3). Een positieve Siiltibcy®-reactie (≥5 mm) hoeft niet bevestigd te worden met een IGRA (Niveau 4).
- Ter voorkoming van boosting van de IGRA reactie door THT is het zinvol de vervolg IGRA binnen 3 dagen na het zetten van de THT af te nemen (Niveau 3).
- Voorafgaand aan screening op TBI is het zinvol factoren die bijdragen aan een anergische respons anamnestisch vast te leggen: symptomen passend bij actieve tuberculose, immuunsuppressieve aandoeningen en medicatie, ernstige co-morbiditeit, recente vaccinatie met levend verzwakt vaccin of virale infecties (Niveau 4).
Aanbevelingen NVMM (Nederlandse Vereniging voor Medische Microbiologie)-richtlijn
- Afhankelijk van de klinische en epidemiologische context en andere beschikbare informatie dient in overweging genomen te worden de QFT-test te herhalen wanneer waarden binnen het zogenoemde grijze gebied (0,20-0,70 IU/ml) worden vastgesteld (Niveau 3).
- Bij indeterminate uitslagen van de IGRA bij een immuuncompetente persoon dient het onderzoek éénmaal te worden herhaald (Niveau 4).
- Bij de interpretatie van de testen is het aanbevolen naast de dichotome uitslag (positief/negatief) ook de kwantitatieve resultaten in beschouwing te nemen (Niveau 4).
Positieve en negatieve voorspellende waarde
Voor alle TBI ( Tuberculose-infectie)-testen geldt dat de positief en negatief voorspellende waarde voor TBI niet alleen wordt bepaald door sensitiviteit en specificiteit maar ook door de prevalentie van TBI in de groep die wordt onderzocht. Dit betekent dat in situaties met een lage prevalentie zoals een test bij een aanstellingskeuring zonder voorgeschiedenis van expositie de kans op een fout-positieve uitslag groter is. De positief voorspellende waarde neemt toe naarmate de a priori kans op besmetting toeneemt, zoals bij contactonderzoek rond een infectieuze patiënt en neemt af bij laagrisico groepen (Arend 2008, Davidow 2009). De negatief voorspellende waarde daalt naarmate de kans op besmetting toeneemt. De positief voorspellende waarde van onderzoek op TBI met THT (Tuberculinehuidtest) en IGRA (interferon-gamma release assay) kan worden verbeterd door de testen te combineren (Arend 2018). Een tool om de positief voorspellende waarde van de testuitslag te berekenen is de Online TST/IGRA Interpreter.
Achtergrondprevalentie van oude infecties
Bij vaststelling van recente infecties moet men rekening houden met de achtergrondprevalentie van oude infecties. In de autochtoon-Nederlandse bevolking geboren sinds 1945 is deze laag. Bij personen afkomstig uit landen met veel tuberculose kan de prevalentie van oude infecties meer dan 15-20% bedragen (Mulder 2012), waardoor een positieve test zowel op een oude als een recente infectie kan wijzen (Kik 2009). De positief voorspellende waarde voor het aantonen van een recente infectie is in deze populatie daarom lager. Dit probleem geldt vanzelfsprekend niet indien beoogd wordt om ook oude infecties aan te tonen, zoals bij patiënten met verminderde immuniteit.
Keuze tussen de testen
Wat zijn de voor- en nadelen van de verschillende testen?
Het belangrijkste voordeel van IGRA (interferon-gamma release assay) en de tbc (Tuberculose)-antigeen huidtesten ten opzichte van de THT (Tuberculinehuidtest) is de hogere specificiteit door het ontbreken van beïnvloeding door voorafgaande BCG (Bacillus Calmette-Guérin)-vaccinatie of infectie met de meeste NTM (nontuberculeuze mycobacteriën)’s. Daarom kunnen de IGRA’s en de tbc-antigeen huidtesten evenzeer worden toegepast bij BCG-gevaccineerde als bij BCG-ongevaccineerde personen. De leeftijd waarop de (laatste) vaccinatie plaatsvond, een kenmerk dat wel effect heeft op de THT-respons, maakt hierbij niet uit. In Tabel 3 zijn de voornaamste verschillen tussen IGRA, THT en tbc-antigeentesten voor de toepassing in de dagelijkse praktijk weergegeven. Voor de huidtesten geldt dat deskundigheid in het zetten en aflezen van de testen moet worden ontwikkeld en behouden.
| IGRA | THT | Tbc-antigeen huidtesten | |
|---|---|---|---|
| Evidence | Niveau 2 | Niveau 2 | Niveau 3. Totaal <3000 onderzochte personen beschreven in publicaties. |
| Uitvoering |
|
|
|
| Kosten | Kosten voor materiaal en laboratorium analyse relatief hoog | Relatief goedkoop, aparte infrastructuur nodig | Relatief goedkoop, aparte infrastructuur nodig |
| Patiënten contact | Eenmalig bezoek | Twee bezoeken met constante tussenpoos nodig | Twee bezoeken met constante tussenpoos nodig |
| Tijdstip van uitslag en doorlooptijd |
| Aflezen binnen 48-72 uur | Aflezen binnen 48-72 uur |
| Interpretatie bij serieel onderzoek | Complex door reversies en conversies (geen consensus t.a.v. interpretatie) | Complex door reversie, boosting en variatie bij het aflezen van reacties | Nog onbekend |
| Kwaliteit reagentia | Constante kwaliteit onder ISO (International Organization of Standardization) en laboratoriumcondities |
| Nog niet beschikbaar |
| Fouten bij afname en afhandeling | Fouten bij afname en afhandelen van de test kunnen het resultaat beïnvloeden | Fouten bij zetten en aflezen kunnen het resultaat beïnvloeden | Fouten bij zetten en aflezen kunnen het resultaat beïnvloeden |
| Boosting | Boosting van de IGRA-reactie door eerdere THT | Boosting van de THT-reactie door eerdere THT | Nog niet bekend |
| Reactie op BCG-vaccinatie | Geen reactie na BCG-vaccinatie | Kruisreageert met BCG-vaccinatie (effect neonatale vaccinatie is beperkt) | Geen reactie na BCG-vaccinatie |
| Specificiteit | Hoog in alle leeftijdsgroepen | Lager door mogelijke kruisreactie met NTM en BCG | Hoog in alle leeftijdsgroepen |
Stroomschema's
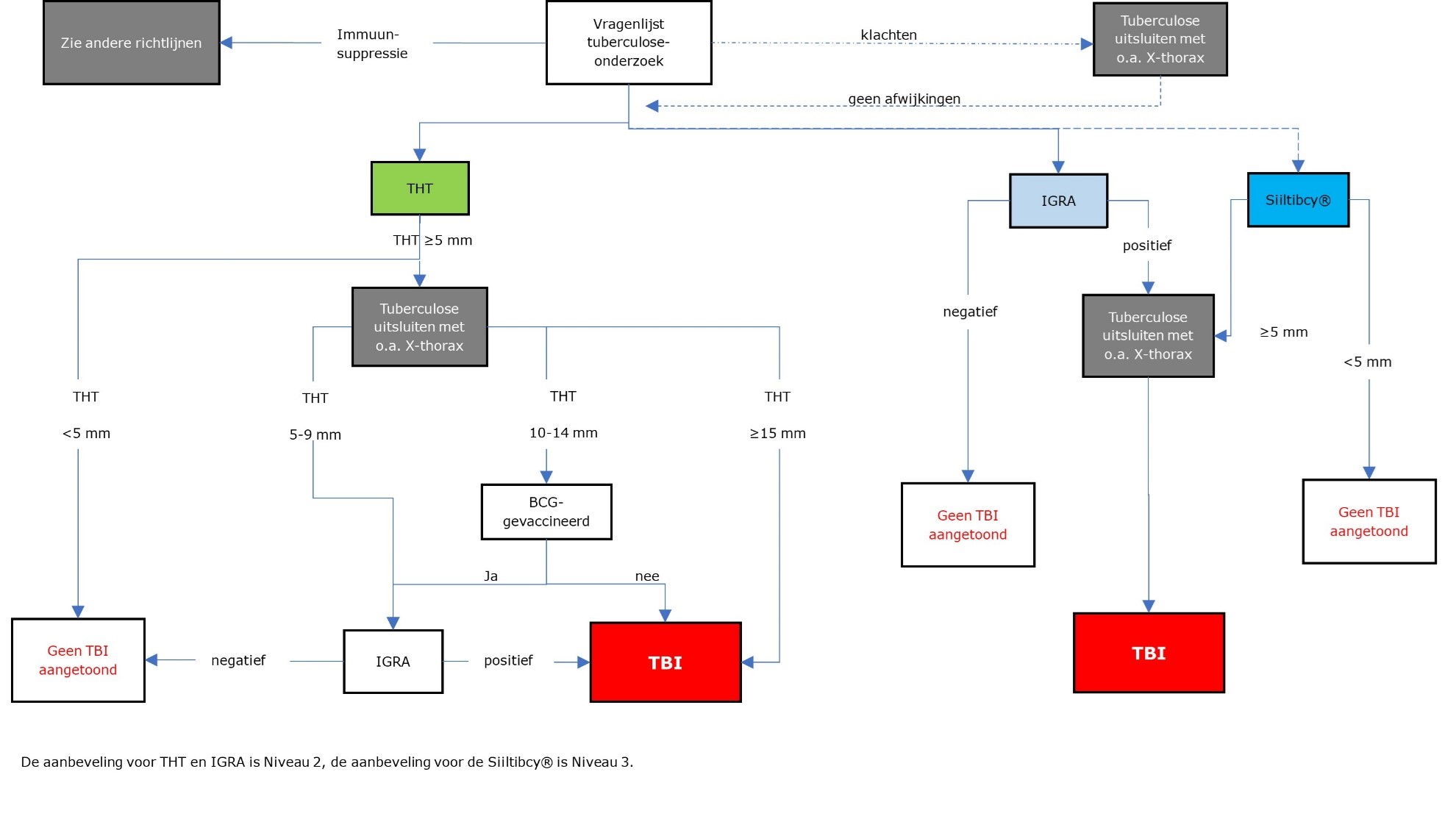
Stroomschema TBI ( Tuberculose-infectie)-testen bij kinderen < 5 jaar, bij bron- en contactonderzoek
Stroomschema TBI-testen bij kinderen < 5 jaar, andere indicaties dan bron- en contactonderzoek
Toelichting stroomdiagram
- Kinderen <5 jaar, ongeacht BCG (Bacillus Calmette-Guérin), worden bij voorkeur gescreend met THT (Tuberculinehuidtest) of Siiltibcy®. BCG-gevaccineerde kinderen kunnen ook direct met IGRA (interferon-gamma release assay) gescreend worden.
- Bij alle kinderen met een ‘positieve THT’* of Silltibcy® ≥5 mm of een positieve IGRAmoet actieve tuberculose worden uitgesloten.
* Beoordeling THT:
- Bij BCG-gevaccineerde kinderen <5 jaar:
- Uitslag van de THT ≥15 mm prevaleert, een aanvullende IGRA heeft geen toegevoegde waarde.
- Indien THT ≥5 mm en <15 mm: vervolgtest met IGRA --> uitslag van IGRA prevaleert.
- Bij kinderen <5 jaar, geen BCG-vaccinatie, of BCG-vaccinatie status onbekend:
- Uitslag van de THT ≥10 mm prevaleert, een aanvullende IGRA heeft geen toegevoegde waarde.
- Indien THT ≥5 mm en <10 mm: vervolgtest met IGRA --> uitslag van IGRA prevaleert.
Aanbeveling
De sensitiviteit van TBI ( Tuberculose-infectie)-testen is verlaagd bij kinderen <2 jaar. Als er een indicatie is om TBI-diagnostiek te doen (bijvoorbeeld na contact met een patiënt met infectieuze longtuberculose) bij kinderen <2 jaar, is primaire profylaxe te adviseren, dus zonder vooraf te testen. (Niveau 4)
Overwegingen
Het is van belang te realiseren dat een positieve THT (Tuberculinehuidtest), Siiltibcy® en/of IGRA (interferon-gamma release assay) bij jonge kinderen duidt op recente infectie en daarmee de kans op het nog ontwikkelen van tuberculose relatief groot is. De kans op ziekteontwikkeling bij immuuncompetente kinderen jonger dan 5 jaar is 4 à 5 keer hoger dan bij volwassenen en is afhankelijk van de leeftijd (Marais 2004) (zie tabel 4). Bij niet BCG (Bacillus Calmette-Guérin)-gevaccineerde kinderen bestaat hiernaast nog een groot risico op gecompliceerde vormen van tuberculose. Bij kinderen jonger dan 5 jaar is een hoge sensitiviteit van de test die gebruikt wordt om TBI ( Tuberculose-infectie) te diagnosticeren daarom van groot belang.
| Leeftijd bij primaire infectie | Risico op pulmonale of mediastinale lymfkliertuberculose | Risico op tbc (Tuberculose)-meningitis of miliaire tuberculose |
|---|---|---|
| < 12 maanden | 30-40% | 10-20% |
| 12-24 maanden | 10-20% | 2-5% |
| 2-4 jaar | 5% | 0,5% |
| 5-10 jaar | 2% | < 0,5% |
| >10 jaar | 10-20% | < 0,5% |
Bij kinderen jonger dan 6 maanden wordt de sensitiviteit van de THT gering geacht door de nog onvolledige ontwikkeling van het immuunsysteem. Echter, verscheidene onderzoeken hebben aangetoond dat antigeen-geïnduceerde interferon-gamma respons significant hoger zijn bij kinderen dan bij volwassenen, met andere woorden: het vermogen van T-cellen om een M.tuberculosis complex specifieke interferon-gamma respons te genereren wordt niet beïnvloed door jonge leeftijd (Hesseling 2009, Tebruegge 2014). Indeterminate resultaten van de IGRA worden wel vaker vastgesteld bij kinderen <5 jaar (Haustein 2009, Tebruegge 2014). Dit treedt op bij onvoldoende respons op de positieve mitogene controle. Enkele studies beschreven dat dit bij jonge kinderen vaker voorkomt dan bij kinderen ≥5 jaar (Bergamini 2009, Haustein 2009) maar dit is onvoldoende systematisch onderzocht (Sollai 2014).
Twee systematische reviews vergeleken de prestaties van IGRA in kinderen. Machingaidze et al. vergeleken de sensitiviteit van IGRA voor de diagnostiek van kweekbevestigde tuberculose bij immuuncompetente kinderen van 0-18 jaar en vonden een pooled sensitiviteit voor QFT van 75% (95% BI, 63%–85%) (Machingaidze 2011). Mandalakas et al. vergeleken in een systematische review studie de prestaties van de THT, QFT en T-spot voor kinderen jonger dan 5 jaar en van 5 tot en met 19 jaar oud (Mandalakas 2011) (zie Tabel 7). De sensitiviteit bij kinderen jonger dan 5 jaar was respectievelijk 77%, 94% en 74% en de specificiteit 92%, 99% en 92%. Onderzoek van Kay et al. laat zien dat de sensitiviteit van IGRA (80%) en THT (87%) lager is bij kinderen <2 jaar en hetzelfde is bij kinderen 2-4 jaar (beide 91%) (Kay 2018). Zij vonden een hogere sensitiviteit (91%) van IGRA bij kinderen 5-18 jaar dan THT (83%). Het betrof hier ook in alle gevallen testuitslagen bij kinderen met bacteriologische bevestigde tuberculose.
Net als bij volwassenen is de toegevoegde waarde van diagnostiek naar tbc-infectie bij kinderen met een verdenking op tuberculose slechts beperkt: een positieve test maakt geen onderscheid tussen ziekte of TBI en een negatieve test sluit de mogelijkheid van tuberculose-ziekte niet uit. Echter, de combinatie van THT en IGRA verhoogt de sensitiviteit voor identificatie van kinderen met actieve tuberculose (Bamford 2010).
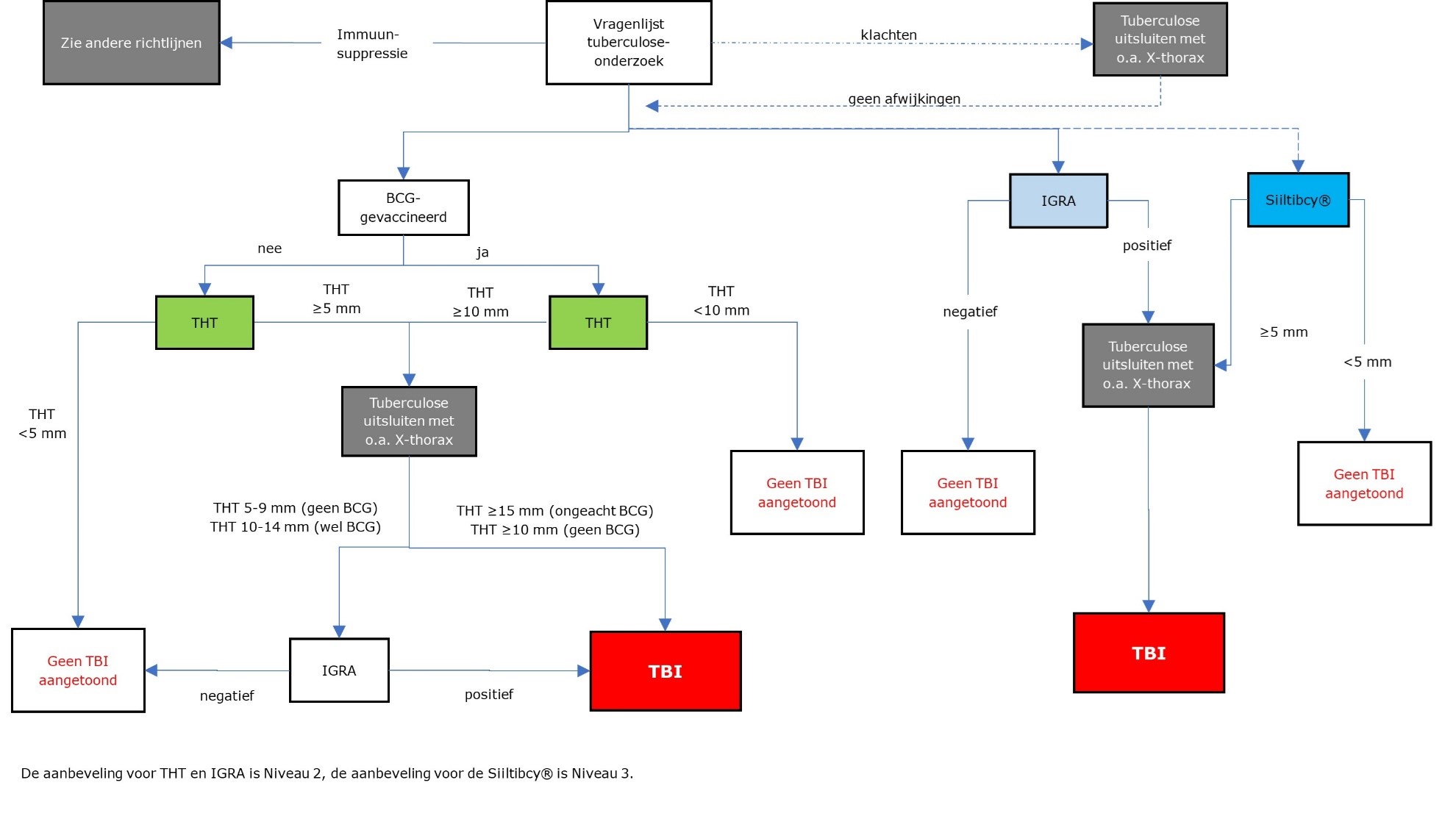
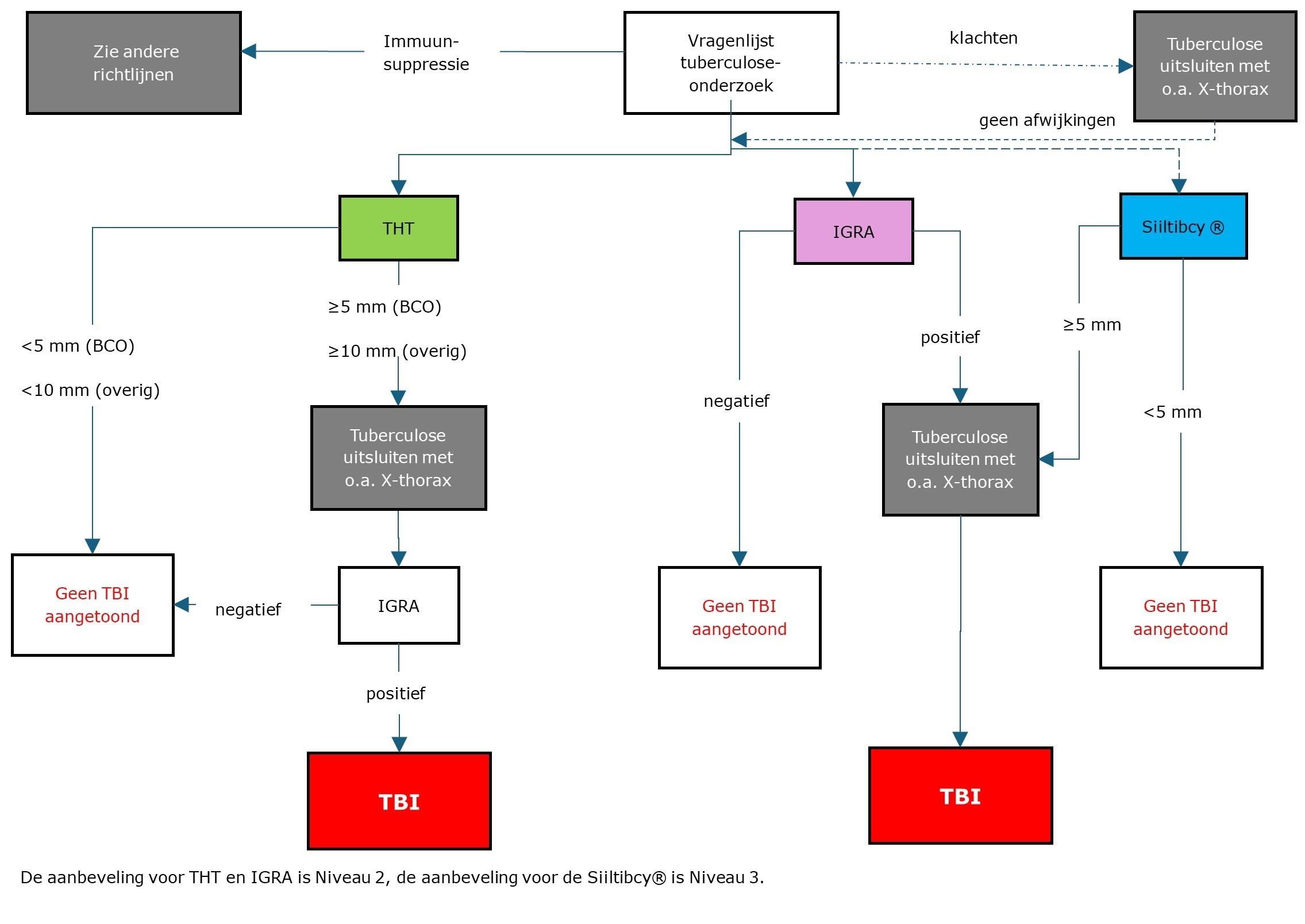
Stroomschema TBI-testen bij personen ≥ 5 jaar (normale immuniteit)
Toelichting stroomdiagram
Er zijn verschillende indicaties voor TBI-onderzoek met daarbij ook verschillen in testbeoordeling. Voor alle indicaties geldt dat bij positieve TBI-diagnostiek actieve tuberculose moet worden uitgesloten alvorens met een preventieve behandeling wordt gestart. (Niveau 2)
Indicatie en afkappunt THT bij bron- en contactonderzoek
- Bij eersteringscontacten van besmettelijke indexpatiënten moet in verband met de beperkte sensitiviteit van TBI-diagnostiek om actieve tuberculose vast te stellen, ook altijd actieve tuberculose middels X-thorax en medisch onderzoek uitgesloten worden.
- Indien THT ≥ 5 mm: vervolgtest met IGRA. De uitslag van IGRA prevaleert.
- Bij testuitslagen in de tweede ronde van het contactonderzoek, dient rekening gehouden te worden met boosting van de THT-respons bij initiële THT-reacties >3 mm.
Indicatie en afkappunt THT bij eenmalig onderzoek bij normale immuniteit
Eenmalig onderzoek vindt plaats bij aanstellingskeuring van ziekenhuismedewerkers, reizigers naar /uit endemische gebieden en immigranten bij binnenkomst in Nederland. Het onderzoek kan bestaan uit een THT gevolgd door een IGRA in geval van THT-positiviteit, of direct een Siiltibcy® of IGRA. Het aantal te testen personen en de logistieke aspecten in een bepaalde setting kunnen mede bepalen wat de meest praktische en kosteneffectieve benadering is.
- Indien THT ≥ 10 mm: vervolgtest met IGRA. De uitslag van IGRA prevaleert.
Indicatie bij periodieke screening
Onder periodiek onderzoek wordt verstaan (half)jaarlijks onderzoek op TBI van personen die als vrijwilliger of beroepsmatig regelmatig (onbeschermd) contact hebben met ongescreende risicogroepen voor tuberculose of anderszins potentieel worden blootgesteld aan aërosolen met M. tuberculosis complex. Het onderzoek is geïndiceerd bij wie regulier contactonderzoek niet mogelijk is, of met een frequentie van meer dan tweemaal per jaar zou moeten plaatsvinden. Periodieke screening van ziekenhuismedewerkers wordt sinds 2023 niet meer geadviseerd, waardoor er nog maar een beperkte indicatie is voor periodieke screening, zoals voor medewerkers microbiologische laboratoria die tbc-diagnostiek verrichten. (Zie Richtlijn Tuberculosescreeningsbeleid contactgroepen (anders dan ziekenhuismedewerkers) (2014)).
Bij periodieke IGRA-screening van ziekenhuismedewerkers is gebleken dat positieve IGRA-uitslagen, IGRA-conversies en IGRA-reversies met waarden nabij het afkappunt vaker voorkomen dan verwacht. Dit heeft geleid tot de conclusie dat het gebruik van IGRA-testen voor periodiek onderzoek in settings met een relatief laag risico op expositie kritisch moet worden beoordeeld (Pai 2007, Ringshausen 2012, Thanassi 2012, Zwerling 2013, Arend 2017).
In geval van periodiek onderzoek kan men bij mensen met een hoge kans op een eerdere infectie overwegen een THT-uitgangswaarde te bepalen. Dit om te voorkomen dat door boosting van de THT-reactie als gevolg van de blootstelling aan M. tuberculosis complex-antigenen in de THT een schijnbare conversie wordt vastgesteld.
Literatuur
- Aggerbeck, H. et al. (2013) ‘Randomised clinical trial investigating the specificity of a novel skin test (C-Tb) for diagnosis of M. tuberculosis infection’, PloS One, 8(5), p. e64215. Available at: .
- Aggerbeck, H. et al. (2018) ‘C-Tb skin test to diagnose Mycobacterium tuberculosis infection in children and HIV (humaan Immunodeficientievirus)-infected adults: A phase 3 trial’, PloS One, 13(9), p. e0204554. Available at: .
- Aggerbeck, H. et al. (2019) ‘Interaction between C-Tb and PPD given concomitantly in a split-body randomised controlled trial’, The International Journal of Tuberculosis and Lung Disease, 23(1), pp. 38–44. Available at: .
- Andersen, P. et al. (2000) ‘Specific immune-based diagnosis of tuberculosis’, Lancet (London, England), 356(9235), pp. 1099–1104.
- Anibarro, L. et al. (2011) ‘Interferon-γ release assays in tuberculosis contacts: is there a window period?’, The European Respiratory Journal, 37(1), pp. 215–217.
- Arend, S.M. et al. (2002) ‘Tuberculin skin testing and in vitro T cell responses to ESAT-6 and culture filtrate protein 10 after infection with Mycobacterium marinum or M. kansasii’, The Journal of Infectious Diseases, 186(12), pp. 1797–1807.
- Arend, S.M. et al. (2005) ‘ESAT-6 and CFP-10 in clinical versus environmental isolates of Mycobacterium kansasii’, The Journal of Infectious Diseases, 191(8), pp. 1301–1310.
- Arend, S.M. (2008) ‘De waarde van interferon-γ-testen bij de diagnostiek van infectie met Mycobacterium tuberculosis’, Tijdschr Infect, 3, pp. 182–9.
- Arend S.M. et al (2017) Prediction and prevention of tuberculosis in contacts. Lancet Infect Dis. 2017 Dec;17(12):1237.
- Arend, S.M. et al.(2018) ‘Performance of Xpert MTB/RIF Ultra: a matter of dead or alive’, The Lancet Infectious Diseases, 18(1), pp. 8–10.
- Bamford, A.R.J. et al. (2010) ‘Comparison of interferon-gamma release assays and tuberculin skin test in predicting active tuberculosis (TB) in children in the UK (United Kingdom): a paediatric TB (tuberculose) network study’, Archives of Disease in Childhood, 95(3), pp. 180–186. Available at: https://doi.org/10.1136/adc.2009.169805.
- Barcellini, L. et al. (2016) ‘First evaluation of QuantiFERON-TB Gold Plus performance in contact screening’, The European Respiratory Journal, 48(5), pp. 1411–1419. Available at: https://doi.org/10.1183/13993003.00510-2016.
- Bélard, E. et al. (2011) ‘Prednisolone treatment affects the performance of the QuantiFERON gold in-tube test and the tuberculin skin test in patients with autoimmune disorders screened for latent tuberculosis infection’, Inflammatory Bowel Diseases, 17(11), pp. 2340–2349. Available at: https://doi.org/10.1002/ibd.21605.
- Bentzon, J.W. (1953) ‘The effect of certain infectious diseases on tuberculin allergy’, Tubercle, 34(2), pp. 34–41. Available at: https://doi.org/10.1016/s0041-3879(53)80013-9.
- Bergamini, B.M. et al. (2009) ‘Performance of commercial blood tests for the diagnosis of latent tuberculosis infection in children and adolescents’, Pediatrics, 123(3), pp. e419-424.
- Bleiker, M.A. et al. (1990) ‘The application of the WHO (World Health Organization) standard tuberculin test in the elimination phase of tuberculosis’, Bulletin of the International Union Against Tuberculosis and Lung Disease, 65(2–3), p. 56.
- Borgdorff, M.W. et al. (2011) ‘The incubation period distribution of tuberculosis estimated with a molecular epidemiological approach’, Int J Epidemiol, 40, pp. 964–70.
- Brody, J.A., Overfield, T. and Hammes, L.M. (1964) ‘Depression of the tuberculin reaction by viral vaccines’, The New England Journal of Medicine, 271, pp. 1294–1296. A
- Chen, H.-Y. et al. (2012) ‘Molecular detection of rifabutin-susceptible Mycobacterium tuberculosis’, Journal of Clinical Microbiology, 50(6), pp. 2085–2088.
- Christie, L.J. et al. (2008) ‘Diagnostic challenges of central nervous system tuberculosis’, Emerging Infectious Diseases, 14(9), pp. 1473–1475.
- Cobelens, F.G. et al. (2006) ‘Tuberculin skin testing in patients with HIV infection: limited benefit of reduced cutoff values’, Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America, 43(5), pp. 634–639. Available at: https://doi.org/10.1086/506432.
- Comstock, G.W. et al. (1964) ‘A comparison in the United States of America of two tuberculins, PPD-S and RT (Real Time) 23’, Bulletin of the World Health Organization, 31(2), pp. 161–170.
- Comstock, G.W. et al. (1974) ‘The prognosis of a positive tuberculin reaction in childhood and adolescence’, American journal of epidemiology, 99(2), pp. 131–138.
- Davidow, A.L. (2009) ‘Interferon-gamma release assay test characteristics depend upon the prevalence of active tuberculosis’, The International Journal of Tuberculosis and Lung Disease: The Official Journal of the International Union Against Tuberculosis and Lung Disease, 13(11), pp. 1411–1415.
- Edwards, L.B. et al. (1969) ‘An atlas of sensitivity to tuberculin, PPD-B, and histoplasmin in the United States’, The American Review of Respiratory Disease, 99(4), p. Suppl:1-132.
- Farhat, M. et al. (2006) ‘False-positive tuberculin skin tests: what is the absolute effect of BCG (Bacillus Calmette-Guérin) and non-tuberculous mycobacteria?’, Int J Tuberc Lung Dis, 10, pp. 1192–204.
- Felten, M.K. et al. (1989) ‘Random variation in tuberculin sensitivity in schoolchildren. Serial skin testing before and after preventive treatment for tuberculosis’, The American Review of Respiratory Disease, 140(4), pp. 1001–1006. Available at: https://doi.org/10.1164/ajrccm/140.4.1001.
- Getahun, H. et al. (2015) ‘Latent Mycobacterium tuberculosis infection’, The New England Journal of Medicine, 372(22), pp. 2127–2135. Available at: https://doi.org/10.1056/NEJMra1405427.
- Gordin, F.M. et al. (1991) ‘Stability of positive tuberculin tests: are boosted reactions valid?’, The American Review of Respiratory Disease, 144(3 Pt 1), pp. 560–563. Available at: https://doi.org/10.1164/ajrccm/144.3_Pt_1.560.
- Grzybowski, S. et al. (1964) ‘The challenge of tuberculosis in decline. A study based on the epidemiology of tuberculosis in Ontaria, Canada’, The American Review of Respiratory Disease, 90, pp. 707–720. Available at: https://doi.org/10.1164/arrd.1964.90.5.707.
- Guld, J. (1957) ‘Interpretation of tuberculin reactions in populations with a high proportion of BCG-vaccinated persons’, Bulletin of the World Health Organization, 17(2), pp. 225–248.
- Guld, J. et al. (1958) ‘Standardization of a new batch of purified tuberculin (PPD) intended for international use’, Bulletin of the World Health Organization, 19(5), pp. 845–951.
- Harboe, M. et al. (1996) ‘Evidence for occurrence of the ESAT-6 protein in Mycobacterium tuberculosis and virulent Mycobacterium bovis and for its absence in Mycobacterium bovis BCG’, Infection and Immunity, 64(1), pp. 16–22. Available at: https://doi.org/10.1128/iai.64.1.16-22.1996.
- Haustein, T. et al. (2009) ‘The likelihood of an indeterminate test result from a whole-blood interferon-gamma release assay for the diagnosis of Mycobacterium tuberculosis infection in children correlates with age and immune status’, The Pediatric Infectious Disease Journal, 28(8), pp. 669–673. Available at: https://doi.org/10.1097/INF.0b013e3181a16394.
- Hesseling, A.C. et al. (2009) ‘Highly discordant T cell responses in individuals with recent exposure to household tuberculosis’, Thorax, 64(10), pp. 840–846. Available at: https://doi.org/10.1136/thx.2007.085340.
- Houk, V.N. et al. (1968) ‘The eradication of tuberculosis infection by isoniazid chemoprophylaxis’, Archives of Environmental Health, 16(1), pp. 46–50. Available at: https://doi.org/10.1080/00039896.1968.10665013.
- Hughes, L.E. and Mackay, W.D. (1965) ‘Suppression of the tuberculin response in malignant disease’, British Medical Journal, 2(5474), pp. 1346–1348. Available at: https://doi.org/10.1136/bmj.2.5474.1346.
- Hsu, K.H. (1983) ‘Tuberculin reaction in children treated with isoniazid’, American Journal of Diseases of Children (1960), 137(11), pp. 1090–1092. Available at: https://doi.org/10.1001/archpedi.1983.02140370050016.
- Joos, T.J. et al. (2006) ‘Tuberculin reactivity in bacille Calmette-Guérin vaccinated populations: a compilation of international data’, The International Journal of Tuberculosis and Lung Disease: The Official Journal of the International Union Against Tuberculosis and Lung Disease, 10(8), pp. 883–891.
- Kay, A.W. et al. (2018) ‘Interferon-γ Release Assay Performance for Tuberculosis in Childhood’, Pediatrics, 141(6), p. e20173918. Available at: https://doi.org/10.1542/peds.2017-3918.
- Kik, S.V. et al. (2009) ‘Interferon-gamma release assays in immigrant contacts and effect of remote exposure to Mycobacterium tuberculosis’, The International Journal of Tuberculosis and Lung Disease: The Official Journal of the International Union Against Tuberculosis and Lung Disease, 13(7), pp. 820–828.
- Krutikov, M. et al. (2022) ‘The diagnostic performance of novel skin-based in-vivo tests for tuberculosis infection compared with purified protein derivative tuberculin skin tests and blood-based in vitro interferon-γ release assays: a systematic review and meta-analysis’, The Lancet. Infectious Diseases, 22(2), pp. 250–264. Available at: https://doi.org/10.1016/S1473-3099(21)00261-9.
- Lee, S.W. et al. (2011) ‘Time interval to conversion of interferon-gamma release assay after exposure to tuberculosis’, The European Respiratory Journal, 37(6), pp. 1447–1452. Available at: https://doi.org/10.1183/09031936.00089510.
- Leyten, E.M.S. et al. (2007) ‘Effect of tuberculin skin testing on a Mycobacterium tuberculosis-specific interferon-gamma assay’, The European Respiratory Journal, 29(6), pp. 1212–1216. Available at: https://doi.org/10.1183/09031936.00117506.
- Machingaidze, S. et al. (2011) ‘The utility of an interferon gamma release assay for diagnosis of latent tuberculosis infection and disease in children: a systematic review and meta-analysis’, The Pediatric Infectious Disease Journal, 30(8), pp. 694–700. Available at: https://doi.org/10.1097/INF.0b013e318214b915.
- Mack, U. et al. (2009) ‘LTBI: latent tuberculosis infection or lasting immune responses to M. tuberculosis? A TBNET consensus statement’, The European Respiratory Journal, 33(5), pp. 956–973. Available at: https://doi.org/10.1183/09031936.00120908.
- Mandalakas, A.M. et al. (2011) ‘Interferon-gamma release assays and childhood tuberculosis: systematic review and meta-analysis’, The International Journal of Tuberculosis and Lung Disease: The Official Journal of the International Union Against Tuberculosis and Lung Disease, 15(8), pp. 1018–1032. Available at: https://doi.org/10.5588/ijtld.10.0631.
- Marais, B.J. et al. (2004) ‘The natural history of childhood intra-thoracic tuberculosis: a critical review of literature from the pre-chemotherapy era’, Int J Tuberc Lung Dis, 8, pp. 392–402.
- Mellman, W.J. and Wetton, R. (1963) ‘Depression of the tuberculin reaction by attenuated measles virus vaccine’, The Journal of Laboratory and Clinical Medicine, 61, pp. 453–458.
- Menzies, D. (1999) ‘Interpretation of repeated tuberculin tests. Boosting, conversion, and reversion’, Am J Respir Crit Care Med, 159, pp. 15–21.
- Menzies, D. (2000a) ‘Tuberculin skin testing’, in Reichman LB HE, editor. Tuberculosis. A comprehensive international approach. 2nd rev ed. New York: Marcel Dekker, pp. 279–322.
- Menzies, D. (2000b) ‘What Does Tuberculin Reactivity after Bacille Calmette-Guerin Vaccination Tell Us?’, Clinical Infectious Diseases, 31(Supplement 3), pp. S71–S74. Available at: https://doi.org/10.1086/314075.
- Metcalfe, J.Z. et al. (2013) ‘Test variability of the QuantiFERON-TB gold in-tube assay in clinical practice’, American Journal of Respiratory and Critical Care Medicine, 187(2), pp. 206–211. Available at: https://doi.org/10.1164/rccm.201203-0430OC.
- Moon, H.-W. et al. (2017) ‘Evaluation of QuantiFERON-TB Gold-Plus in Health Care Workers in a Low-Incidence Setting’, Journal of Clinical Microbiology, 55(6), pp. 1650–1657. Available at: https://doi.org/10.1128/JCM.02498-16.
- Mori, T. and Shiozawa, K. (1985) ‘Suppression of tuberculin hypersensitivity caused by rubella infection’, The American Review of Respiratory Disease, 131(6), pp. 886–888.
- Mulder, C. et al. (2012) ‘Role of the QuantiFERON(R)-TB Gold In-Tube assay in screening new immigrants for tuberculosis infection’, Eur Respir J, 40(6), pp. 1443–1449. Available at: https://doi.org/10.1183/09031936.00010612.
- Pai, M. et al. (2006) ‘New tools and emerging technologies for the diagnosis of tuberculosis: part I. Latent tuberculosis’, Expert Review of Molecular Diagnostics, 6(3), pp. 413–422. Available at: https://doi.org/10.1586/14737159.6.3.413.
- Pai, M. et al. (2007). Serial testing for tuberculosis: can we make sense of T cell assay conversions and reversions? PLoS (Plos One) Med. 2007 Jun;4(6):e208.
- Pai, M. et al. (2014) ‘Gamma interferon release assays for detection of Mycobacterium tuberculosis infection’, Clinical microbiology reviews, 27(1), pp. 3–20. Available at: https://doi.org/10.1128/CMR.00034-13.
- Palmer, C.E. (1953) ‘Tuberculin sensitivity and contact with tuberculosis; further evidence of nonspecific sensitivity’, American Review of Tuberculosis, 68(5), pp. 678–694.
- Pelly, T.F. et al. (2005) ‘Tuberculosis skin testing, anergy and protein malnutrition in Peru’, The International Journal of Tuberculosis and Lung Disease: The Official Journal of the International Union Against Tuberculosis and Lung Disease, 9(9), pp. 977–984.
- Pieterman, E.D. et al. (2018) ‘A multicentre verification study of the QuantiFERON®-TB Gold Plus assay’, Tuberculosis, 108, pp. 136–142. Available at: https://doi.org/10.1016/j.tube.2017.11.014.
- Ringshausen FC et al. (2012) Interferon-gamma release assays for the tuberculosis serial testing of health care workers: a systematic review. J Occup Med Toxicol. 2012 Jun 18;7(1):6.
- Rooney, J.J. et al. (1976) ‘Further observations on tuberculin reactions in active tuberculosis’, The American Journal of Medicine, 60(4), pp. 517–522. Available at: https://doi.org/10.1016/0002-9343(76)90718-x.
- Ruhwald, M. et al. (2017) ‘Safety and efficacy of the C-Tb skin test to diagnose Mycobacterium tuberculosis infection, compared with an interferon γ release assay and the tuberculin skin test: a phase 3, double-blind, randomised, controlled trial’, The Lancet. Respiratory Medicine, 5(4), pp. 259–268. Available at: https://doi.org/10.1016/S2213-2600(16)30436-2.
- Russell, D.G. (2001) ‘Mycobacterium tuberculosis: here today, and here tomorrow’, Nature Reviews. Molecular Cell Biology, 2(8), pp. 569–577. Available at: https://doi.org/10.1038/35085034.
- Smith-Rohrberg, D. and Sharma, S.K. (2006) ‘Tuberculin skin test among pulmonary sarcoidosis patients with and without tuberculosis: its utility for the screening of the two conditions in tuberculosis-endemic regions’, Sarcoidosis, vasculitis, and diffuse lung diseases: official journal of WASOG, 23(2), pp. 130–134.
- Sollai, S. et al. (2014) ‘Systematic review and meta-analysis on the utility of Interferon-gamma release assays for the diagnosis of Mycobacterium tuberculosis infection in children: a 2013 update’, BMC infectious diseases, 14 Suppl 1(Suppl 1), p. S6. Available at: https://doi.org/10.1186/1471-2334-14-S1-S6.
- Stead, W.W. et al. (1987) ‘The significance of the tuberculin skin test in elderly persons’, Annals of Internal Medicine, 107(6), pp. 837–842. Available at: https://doi.org/10.7326/0003-4819-107-6-837.
- Steiner, P. et al. (1980) ‘Persistently negative tuberculin reactions: their presence among children with culture positive for Mycobacterium tuberculosis (tuberculin-negative tuberculosis)’, American Journal of Diseases of Children (1960), 134(8), pp. 747–750. .
- Tamashiro, V.G., Perez, H.H. and Griffin, D.E. (1987) ‘Prospective study of the magnitude and duration of changes in tuberculin reactivity during uncomplicated and complicated measles’, The Pediatric Infectious Disease Journal, 6(5), pp. 451–454.
- Tebruegge, M. et al. (2014) ‘Extremes of age are associated with indeterminate QuantiFERON-TB gold assay results’, Journal of Clinical Microbiology, 52(7), pp. 2694–2697. .
- Thanassi W et al. (2012) Delineating a Retesting Zone Using Receiver Operating Characteristic Analysis on Serial QuantiFERON Tuberculosis Test Results in US Healthcare Workers. Pulm Med. 2012;2012:291294.
- Tufariello, J.M. et al. (2003) ‘Latent tuberculosis: mechanisms of host and bacillus that contribute to persistent infection’, The Lancet. Infectious Diseases, 3(9), pp. 578–590.
- Van den Brande, P. et al. (1992) ‘Four-stage tuberculin testing in elderly subjects induces age-dependent progressive boosting’, Chest, 101(2), pp. 447–450.
- Van Zyl-Smit, R.N. et al. (2009) ‘Within-subject variability and boosting of T-cell interferon-gamma responses after tuberculin skin testing’, American Journal of Respiratory and Critical Care Medicine, 180(1), pp. 49–58.
- Veerapathran, A. et al. (2008) ‘T-cell assays for tuberculosis infection: deriving cut-offs for conversions using reproducibility data’, PloS One, 3(3), p. e1850.
- Verbon, A. and Cobelens, F.G.J. (2003) ‘[Indications for, and the significance of, the tuberculin test in the Netherlands]’, Nederlands tijdschrift voor geneeskunde, 147(12), pp. 539–543.
- Weiss, E.S. (1953) ‘Tuberculin sensitivity in Alaska’, Public Health Reports (Washington, D.C.: 1896), 68(1), pp. 23–27.
- Wessels, G. et al. (1992) ‘The increased risk of developing tuberculosis in children with malignancy’, Annals of Tropical Paediatrics, 12(3), pp. 277–281.
- Whitworth, W.C. et al. (2012) ‘Within-subject interlaboratory variability of QuantiFERON-TB gold in-tube tests’, PloS One, 7(9), p. e43790.
- WHO (2014) Guidelines on the management of latent tuberculosis infection. WHO/HTM/TB/2015.01. Geneva: World Health Organization.
- WHO (2017) Ethics guidance for the implementation of the End TB strategy. Geneva: World Health Organization.
- WHO (2020) WHO consolidated guidelines on tuberculosis:. Module 1 Prevention - tuberculosis preventive treatment. WHO/HTM/TB/2017.04. Geneva: World Health Organization.
- WHO (2022) WHO consolidated guidelines on tuberculosis. Module 3: Diagnosis – Tests for tuberculosis infection. Geneva: World Health Organization.
- Woodruff, C.E. and Chapman, P.T. (1971) ‘Tuberculin sensitivity in elderly patients’, The American Review of Respiratory Disease, 104(2), pp. 261–263.
- Zwerling A, et al. (2013) Repeat IGRA (interferon-gamma release assay) testing in Canadian health workers: conversions or unexplained variability? PLoS One. 2013;8(1):e54748.
- van Zyl-Smit, R.N. et al. (2009) ‘Within-subject variability of interferon-g assay results for tuberculosis and boosting effect of tuberculin skin testing: a systematic review’, PloS One, 4(12), p. e8517.
Verantwoording
Werkwijze van de werkgroep
De richtlijn is in opdracht van de Commissie voor Praktische Tuberculosebestrijding (CPT) opgesteld door een multidisciplinaire werkgroep bestaande uit een internist-infectioloog, een longarts, een kinderarts, een arts-microbioloog, een epidemioloog en artsen maatschappij en gezondheid tuberculosebestrijding. De CPT (Commissie voor Praktische Tuberculosebestrijding) heeft de werkgroep de opdracht gegeven om de bestaande richtlijnen voor de diagnostiek te herzien.
De voorgaande richtlijn was een update en samenvoeging van de CPT-richtlijn documenten ‘Tuberculine Handout’ (2005) en de ‘Richtlijn Interferon Gamma Release Assays bij de diagnostiek van tuberculose’ (2011). In 2019 is geen systematisch literatuuronderzoek verricht volgens de werkwijze van het Kwaliteitsinstituut voor de Gezondheidszorg (CBO), maar werd gebruik gemaakt van nationale en internationale richtlijnen (NICE Guidelines, Canadian Tuberculosis Standards, IGRA (interferon-gamma release assay) guidance ECDC (European Centre for Disease Prevention and Control) en WHO (World Health Organization) consolidated guidelines on tuberculosis (module 1)) en meest recente overzichtsartikelen uit de wetenschappelijke literatuur over de diagnostiek van TBI ( Tuberculose-infectie).
Wetenschappelijke onderbouwing
Hoewel bij de totstandkoming van deze richtlijn geen sprake was van een systematisch literatuuronderzoek in strikte zin, heeft de werkgroep toch gemeend tegemoet te moeten komen aan de behoefte in het werkveld aan een weging van de zwaarte van het wetenschappelijk bewijs. De conclusies en aanbevelingen worden gestaafd door beschreven literatuur, waarbij de mate van bewijskracht (A-D) en het niveau van aanbeveling (1-4) worden weergegeven.
De werkgroep heeft de criteria van tabel 5 gebruikt om de zwaarte van het wetenschappelijk bewijs te bepalen en conclusies te formuleren.
|
Het wetenschappelijke bewijs is daar waar relevant, samengevat in een conclusie, met vermelding van de literatuur en de mate van bewijs (A-D). De conclusies en bevindingen zijn vertaald naar aanbevelingen met niveau-aanduiding (tabel 6).
|
Werkgroep
Werkgroep Diagnostiek TBI - Commissie voor Praktische Tuberculosebestrijding
Samenstelling werkgroep
Dr. (Doctor) O.W. Akkerman, longarts UMCG (Universitair Medisch Centrum Groningen) (namens NVALT (Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose) )
Dr. S.M. Arend, internist-infectioloog LUMC (Leids Universitair Medisch Centrum)
Drs. E. Huisman, arts maatschappij & gezondheid, GGD (Gemeentelijke Gezondheidsdienst) Noord en Oost-Gelderland (namens VvAwT)
Dr. I. Spruijt, senior-epidemioloog KNCV (Koninklijke Nederlandse Centrale Vereniging (voor tuberculosebestrijding) - Tuberculosis Foundation) Tuberculosefonds
Dr. J.E.M. de Steenwinkel, arts-microbioloog, Erasmus MC (Erasmus University Medical Center), Rotterdam (namens NVMM (Nederlandse Vereniging voor Medische Microbiologie))
R.E. Tomassen, sociaal verpleegkundige, GGD Gelderland-Zuid (namens V&VN (Verpleegkundigen en Verzorgenden Nederland), vakgroep Tuberculose)
Drs. S. Toumanian, arts maatschappij & gezondheid GGD Regio Twente, voorzitter
Drs. A.R. Verhage, kinderarts-infectioloog/immunoloog UMCG/BKZ (namens NVK (Nederlandse vereniging voor Kindergeneeskunde))
Dr. G. de Vries, arts maatschappij & gezondheid, RIVM, secretaris
Publicatiedatum
Deze richtlijn werd besproken en vastgesteld door de CPT-vergadering van 14 maart 2025. De richtlijn is geaccordeerd door de NVK en de NVMM.
Revisie 2030
Belangenverklaringen
Alle leden van de werkgroep zijn onafhankelijk, zonder belangenconflicten of financiële belangen.
Knelpunteninventarisatie
De enquête is april 2024 verstuurd naar artsen en verpleegkundigen tuberculosebestrijding en via de NVALT (Nederlandse Vereniging van Artsen voor Longziekten en Tuberculose), NVK (Nederlandse vereniging voor Kindergeneeskunde) en NVMM (Nederlandse Vereniging voor Medische Microbiologie) naar hun achterban. De response was 23 ingevulde enquêtes.
Resultaten
1. Wat is uw functie?
- 4x arts tuberculosebestrijding werkzaam bij de GGD (Gemeentelijke Gezondheidsdienst)
- 11x longarts werkzaam in het ziekenhuis
- 3x andere specialist werkzaam in het ziekenhuis
- 3x verpleegkundige werkzaam bij de GGD
- 2x andere functie
2. Gebruikt u de CPT (Commissie voor Praktische Tuberculosebestrijding)-richtlijn Diagnostiek (latente) tuberculose-infectie?
- 21x Ja
- 1x Nee
- 1x Nvt
3. De werkgroep zal - op basis van literatuur en de WHO (World Health Organization)-richtlijn - een aanbeveling geven over de nieuwe TB (tuberculose)-antigen huidtesten, zoals de Cy-Tb. Heeft u opmerkingen/aandachtspunten voor de werkgroep over de nieuwe testen?
- Ga na de congruentie met andere bestaande richtlijnen
- Hoe gevoelig is deze test? En hoe snel is uitslag bekend (zichtbaar)?
- Plaatsing t.o.v. huidige testen. Geeft deze test meer duidelijkheid/minder grijs gebied dan huidige diagnostische testen? Immuunincompetente patiënten/HIV en interpretatie bij kinderen?
- Belangrijk om de plaats van dit onderzoek te bepalen echter zonder de huidig richtlijn (stroomdiagrammen) nog ingewikkelder te maken.
- Gebruik bij screening voor start biologicals ipv Quantiferon
- Indicatie bij kinderen?
- Alleen voor Cy-Tb zijn studies uitgevoerd in low-incidence countries en voor de andere 2 TBST zou meer onderzoek nodig zijn voor gebruik in Nederlandse setting.
- Zowel praktische als achtergrondinformatie heel wenselijk.
- We zien uit naar deze nieuwe test.
4. Zijn er volgens u aanpassingen nodig in de huidige aanbevelingen Hoofdstuk 4?
- 6x Nee, 3x geen antwoord
- Ja, bij hoge a priori kans dient ook een TST gezet te worden, aangezien een IGRA (interferon-gamma release assay) alleen positief wordt als er circulerende effector memory T cellen zijn. Bij een zeer hoog a priori risico is een negatieve test onvoldoende om TB-infectie uit te sluiten. (Andere specialist ziekenhuis)
- Aanbeveling 3, eerste deel, hoeft niet
- Aanbeveling 3: Geldt dit alleen voor immuuncompetente mensen of ook voor immuungecompromiteerden? En ook graag toevoegen wat te doen bij positieve Mantoux en voorheen BCG (Bacillus Calmette-Guérin)-vaccinatie. Aanbeveling 4 lijkt het nu dat je IGRA altijd na THT (Tuberculinehuidtest) moet doen, graag verduidelijken dat het de voorkeur heeft de IGRA vóór de THT te doen. Aanbeveling NVVM 2 roept wel vragen op: Hoe zinvol is dit? Misschien wat meer nuance aanbrengen, waaronder nadenken over risico op actieve tuberculose, en ook hoe vaak herhalen? Dan niet juist Mantoux? Meerwaarde ELISpot boven Quantiferon? Daarnaast, graag duidelijk maken indien uitslagen discrepant zijn (positief/negatief): Welke uitslag gebruiken? (Longarts ziekenhuis)
- Aanbeveling 4: 3 dagen later bij boosting? Is dat niet te snel?
- Aanbeveling 4 - wellicht handig toe te voegen "bijvoorbeeld in een CO" want in andere gevallen (bv TNF-screening) booster genomen is juist handig'; NVMM-aanbeveling 2: tijdstip van herhalen - overnemen van NVMM(???) zorg ervoor dat het gelijk is aan de aanbevelingen van NVMM (Arts tuberculosebestrijding)
- Aanbeveling NVMM: 1. Tijdsindicatie waarna of waarbinnen de IGRA herhaald kan worden (wat is zinvol?). 2. Aanbeveling voor alternatieve test indien IRGA 2x indeterminate is, bijv. (bijvoorbeeld) T-spot. 3. Duidelijk vermelden van de kwantitatieve resultaten (is de TB1 of TB2 - de nil of niet). (Arts tuberculosebestrijding)
- Ik vind de laatste aanbeveling uit de NVMM-richtlijn heel ingewikkeld, want wat zeggen ze nou eigenlijk? (Longarts ziekenhuis)
- Beter definiëren welke co-morbiditeit relevant is (huidige tabel komt niet overeen met bijv Osiris gegevens); indeterminate uitslagen en praktijk hierbij; aanbevelingen
- Definitie grijs gebied van zowel TB1 als TB2 buisje; 0.35-0.70? 0.20-0.35? 0.20-0.70?
- Harmonisatie is altijd wenselijk
- Herhalen van test: welke van de 2 testen geeft de goede uitslag? Is dat altijd de door arts of patiënt gewenste uitslag?
- In overleg met tuberculose expertisecentra is altijd het advies om bij twijfel te behandelen (na uitsluiten actieve TBC (Tuberculose)). Dus ter overweging om bij of een positieve THT of IGRA te behandelen.
- De term LTBI (latente tuberculose infectie) zou moeten worden vervangen door TBI ( Tuberculose-infectie) (2x genoemd), hoewel dit in de praktijk tot onduidelijkheid leidt bij m.n. collegaspecialisten. Definieer hoe actieve tuberculose moet worden uitgesloten. (Longarts ziekenhuis)
- Terminologie: TBI
5. Ontbreekt er volgens u onderwerpen of informatie die in de richtlijn zou moeten staan? Indien ja, graag specificeren
- 8x Nee, 8x geen antwoord
- TBST
- Nieuwe testmethoden
- Positieve IGRA bij negatieve mantoux
- Uitleg two step testing misschien als aanvulling
- Bij welke medicatie is er indicatie om de screening te verrichten?
- Voorstel mbt diagnostiek bij (kleine kinderen). Bv gebruik T-spot indien IGRA niet lukt, (bv doordat door de lage vacuüm afname van 4 IGRA buisjes niet lukt).
- Faecestest bij kinderen; waarde in praktijk?
6. Staat er overbodige informatie in de richtlijn? Zo ja, welke?
- 10x Nee, 12x geen antwoord
- QFT GIT kan weggelaten worden
7. Zijn er onderdelen onduidelijk in de richtlijn die aanpassing behoeven? Zo ja, welke?
- 9x Nee, 10x geen antwoord
- Aanpassingen in screeningsbeleid ziekenhuismedewerkers
- Periodieke screening n.a.v. meest recente cpt richtlijn hierover
- Er staat in het algemeen genomen te veel tekst. (Longarts ziekenhuis)
- H 4.2 "Quantiferon testen hebben een positieve (Mitogeen) en negatieve controle (Nil), de T-SPOT.TB alleen een positieve controle”. T spot heeft toch ook een negatieve controle?
8. Zijn de aanbevelingen in de huidige richtlijn goed uitvoerbaar? Zo nee, graag suggesties voor verbeteringen
- 13x Ja, 7x geen antwoord
- Op veel plekken kan geen Mantoux meer verricht worden (of in ieder geval geen goede/betrouwbare Mantoux). (Andere specialist ziekenhuis)
- Een TST is niet overal uitvoerbaar. (Andere specialist ziekenhuis)
- Komt soms wat onoverzichtelijk over
9. Zijn de stroomschema's (p.31-36) duidelijk en goed uitvoerbaar? Zo nee, graag suggesties voor verbeteringen.
- 13x Ja, 9x geen antwoord
- Simplificeren is beter. Het is duidelijk maar er zijn veel subgroepen en zijtakken. In de praktijk wordt vaak laagdrempeliger meteen een IGRA bepaald ipv eerst THT en dit kan overwogen worden om de richtlijn te simplificeren. Dit past ook in de 'nieuwe' visie en richtlijnen voor screening op TBI bij binnenkomst. Administratielast en extra tijd voor MTM worden vaak niet meegenomen in de kosten/baten analyse. (Arts tuberculosebestrijding)
10. Heeft u nog andere knelpunten of aandachtspunten voor de herziening van de richtlijn die u onder de aandacht van de werkgroep wil brengen?
- 9x Nee, 10x geen antwoord
- 1. Waarom TST op de strekzijde ipv zoals wereldwijd op de binnenzijde van de arm? 2. Figuur 1 schematische weergave van de distributie tuberculine reacties is niet goed leesbaar in de pdf. 3. X thorax 1R of 2R (1 richting of 2 richtingen) na positieve test? 4. Is er genoeg evidence om te stellen / adviseren dat T spot een betere screeningstest is bij HIV (humaan Immunodeficientievirus) geïnfecteerden?
- Afweging bij welke reactie (in mm) op de THT men géén IGRA hoeft te prikken. Maar TBI-diagnose al kan stellen
- Gezondheidsvragenlijst te uitgebreid
- Ik zou ervoor pleiten om alle TB gerelateerde richtlijnen op 1 plek te zetten (nu is er RIVM, CPT, KNCV (Koninklijke Nederlandse Centrale Vereniging (voor tuberculosebestrijding) - Tuberculosis Foundation), FMS); het zou ook fijn zijn als de richtlijn screening TB voorafgaande aan immuunsuppressieve therapie samen wordt gevoegd met deze richtlijn. (Longarts ziekenhuis)