Infectieziekten Bulletin, december 2025
Auteurs
Teysir Halaby1, Florien Dusseldorp2, Lydia Fievez3
- Arts-microbioloog, Medische Microbiologie Friesland | Noordoostpolder, Certe, Groningen
- Arts M+G, infectieziektebestrijding, Centrum voor infectieziektebestrijding, RIVM, Bilthoven
- Arts M+G, Infectieziekten, Team Algemene Infectieziekten, GGD (Gemeentelijke Gezondheidsdienst) Amsterdam
Samenvatting
Klimaat is één van de negen grenzen waarbinnen de mensheid moet blijven om duurzaam gebruik te kunnen blijven maken van de hulpbronnen op aarde. Maar met de huidige klimaatverandering wordt deze grens flink overschreden. Dit heeft invloed op infectieziekten. Bijna 60% van de infectieziekten verergert op enig moment door veranderingen in het klimaat. Ook in Nederland zijn de effecten van klimaatverandering op verschillende groepen infectieziekten al merkbaar. Dit artikel beschrijft welke veranderingen invloed hebben op infectieziekten en vat het samen in een helder overzicht.
Inleiding
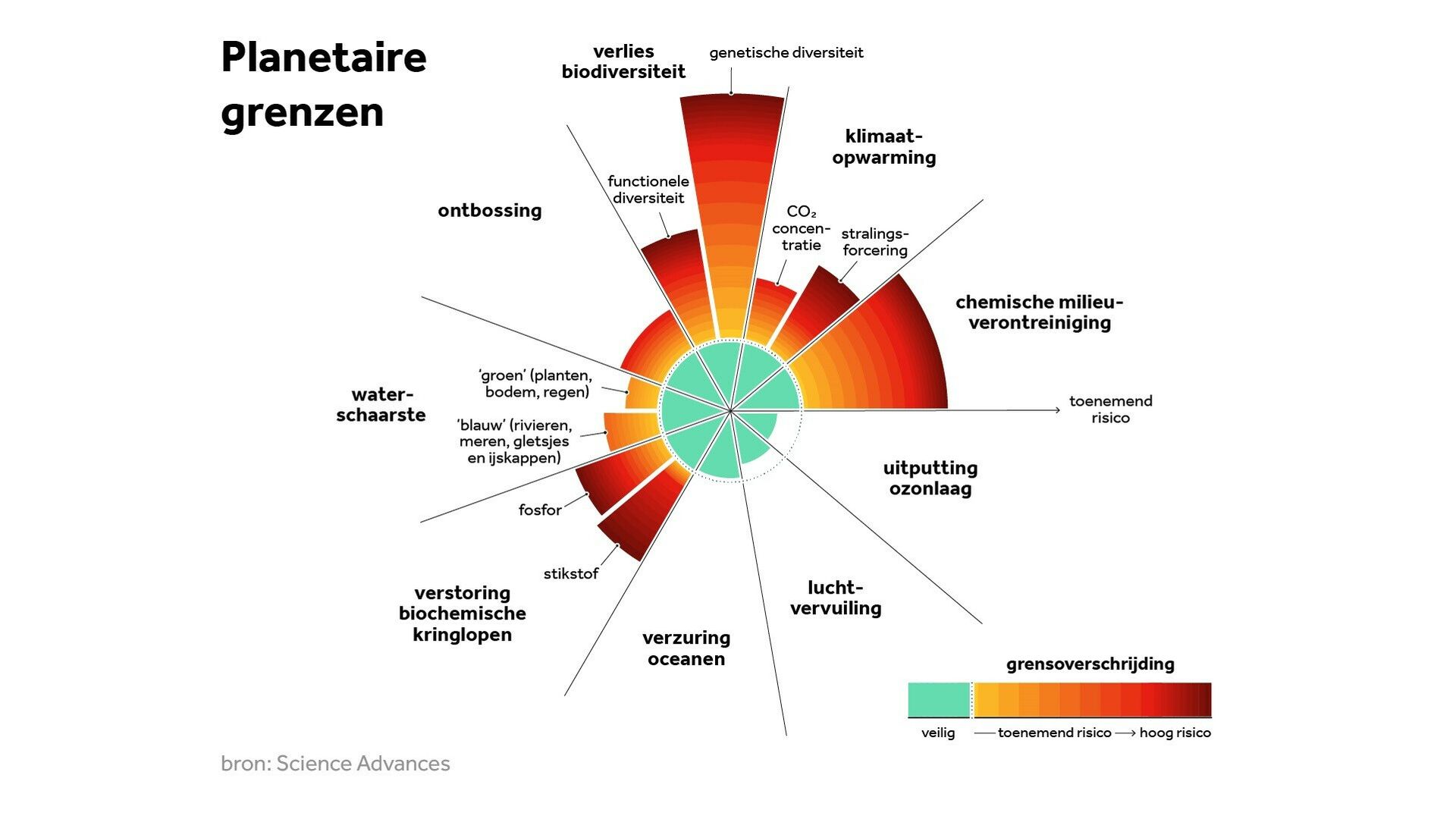
Klimaatverandering is één van de negen ‘planetaire grenzen’: grenzen die in 2009 door wetenschappers zijn vastgesteld waarbinnen de mensheid moet blijven om duurzaam gebruik te kunnen blijven maken van de hulpbronnen op aarde (1). Naast grenzen aan de opwarming van de aarde vallen hieronder ook grenzen aan het verlies van biodiversiteit, de stikstofkringloop/fosforkringloop, het gat in de ozonlaag, oceaanverzuring, waterschaarste, landgebruik, chemische verontreiniging en deeltjes in de atmosfeer. Het overschrijden van deze grenzen kan de stabiliteit die het leven op aarde al duizenden jaren kent, in gevaar brengen (1). Inmiddels worden zes van deze negen grenzen overschreden, zoals Figuur 1 laat zien (2).
(Figuur 1)
Planetaire gezondheid
In het verlengde van de planetaire grenzen introduceerde de Lancet-commissie van The Rockefeller Foundation in 2015 de term ‘planetary health’ (planetaire gezondheid), met de publicatie van een alarmerend rapport over de gezondheidseffecten van de overschrijding van deze planetaire grenzen (3). Waar ‘one health’ zich focust op de samenhang tussen mens, dier en hun gedeelde leefomgeving, kijkt planetary health breder naar de link tussen menselijke gezondheid en alle systemen op aarde, en benadrukt het dat onze gezondheid afhankelijk is van die planeet. Ook in Nederland worden de gevolgen van het overschrijden van de planetaire grenzen steeds zichtbaarder. Dit gebeurt op verschillende manieren, zoals sterfte door hittestress, gezondheidsklachten door verminderde luchtkwaliteit en (pollen)allergieën, en de aanwezigheid van PFAS (Per- en polyfluoralkylstoffen)-concentraties boven de gezondheidskundige grenswaarde in de algemene bevolking (4,5).
Klimaatverandering en infectieziekten
Klimaatverandering vormt een belangrijke bedreiging voor de volksgezondheid wereldwijd (6). Uitingen van klimaatverandering zijn meer neerslagextremen, het vaker voorkomen van zeer warme dagen en stijging van de gemiddelde temperatuur in de loop van de afgelopen eeuw (zie kader).
Broeikaseffect
Een belangrijke aanjager van de temperatuurstijging is het broeikaseffect, dat wordt veroorzaakt door het toegenomen gebruik van fossiele brandstoffen. Reconstructies van het klimaat van de afgelopen tweeduizend jaar laten duidelijk zien dat deze verandering aan het begin van de Industriële Revolutie is ingezet. Vergeleken met het pre-industriële tijdperk (1850 – 1900) steeg de wereldgemiddelde temperatuur met 1,2°C in 2022 (7). Volgens het KNMI (Koninklijk Nederlands Meteorologisch Instituut) vindt in Nederland de opwarming sneller plaats dan het wereldgemiddelde. In 2024 was het in De Bilt 2,9 graden warmer dan het gemiddelde over de periode 1901-1930 (8). De wereldwijde energievoorziening is zo afhankelijk van fossiele brandstoffen dat de huidige klimaatdoelen niet zullen worden gehaald (9). Meerdere sectoren leveren een bijdrage aan het broeikaseffect, waaronder de industrie en de landbouw. Ook de gezondheidszorgsector draagt, met een aandeel van ongeveer 5% bij aan wereldwijde uitstoot van broeikasgassen (10). De Nederlandse zorgsector draagt voor 7% bij aan de nationale klimaatvoetafdruk (11). Deze sector heeft dus ook een verantwoordelijkheid om een bijdrage te leveren aan het terugdringen van het broeikaseffect.
Klimaat, en dus ook verandering hierin, heeft óók een belangrijke invloed op de ‘onzichtbare biotische meerderheid’: de micro-organismen (12,13) – en daarmee infectieziekten. Uit een systematische review uit 2022 bleek dat meer dan 58% van de humane infectieziekten op enig moment is verergerd door klimaatverandering. Het onderzoek laat ook zien dat het verband tussen klimaatverandering en de toename van infectieziekten erg complex is, en toont 1.006 unieke routes waarin klimaatgevaren zoals overstromingen, extreme hitte, regen of droogte hebben geleid tot een toename van infectieziekten (14).
De laatste jaren verschenen er publicaties over de negatieve impact van klimaatverandering op diverse aspecten van de gezondheid in Nederland (15,16). Dit artikel beschrijft de relevantie van de veranderingen van de planetaire gezondheid voor infectieziekten in de Nederlandse context. Deze effecten zijn onderverdeeld in vier groepen:
- direct effect op infectieziekten
- effect via vectoroverdraagbare infectieziekten
- effect via wateroverdraagbare infectieziekten
- effect op zoönosen en ‘emerging infectious diseases’ (opkomende infectieziekten)
Direct effect op infectieziekten
Aanpassing aan hogere temperaturen
Stijging in omgevingstemperatuur kan directe gevolgen hebben op de groei van micro-organismen en voor antimicrobiële resistentie (17), zoals het verwerven van verhoogde thermische tolerantie (18). Candidozyma auris (voorheen Candida auris) is hier een voorbeeld van. C. auris werd voor het eerst in 2009 in Japan beschreven als een veroorzaker van oorontstekingen (auris is ‘oor’ in het Latijn). Sindsdien lijkt de gist zich wereldwijd te hebben verspreid en ziekten te veroorzaken, vooral onder immuun-gecompromitteerde patiënten (19). C. auris is een gist die mogelijk aanvankelijk alleen in de natuur voorkwam als saprofyt, in o.a. (onder andere) moerasland (20). Sommige hypothesen suggereren dat de soort zich heeft aangepast aan de hogere temperaturen in deze ecosystemen, en dat hij uiteindelijk de mogelijkheid heeft gekregen om warmbloedige dieren (zoals mensen) te koloniseren (20). De recente gelijktijdige opkomst van verschillende, niet-verwante klonen van C. auris in geografisch ver van elkaar gelegen gebieden wordt gezien als een gevolg van de opwarming van de aarde (21). Resistentie voor de meeste antimycotica is kenmerkend voor deze gist. C. auris is ook in Nederland geïsoleerd bij patiënten die waren overgeplaatst vanuit een buitenlands ziekenhuis.
Invloed op antimicrobiële resistentie
Temperatuurstijging gaat ook gepaard met verhoogde groeisnelheid van pathogenen en het vergemakkelijkt de horizontale overdracht van genen, waaronder de genen die verantwoordelijk zijn voor antimicrobiële resistentie (22). Antimicrobiële resistentie wordt ook beïnvloed door stijgende concentraties van zware metalen of biociden in de bodem en het water (23), en de verdere verspreiding ervan kan worden verergerd door extreme weersomstandigheden, zoals regenval en overstromingen (24,25).
Temperatuurstijging en antibioticaresistentie
Een studie in de Verenigde Staten verzamelde temperatuurgegevens uit 41 staten tussen 1980 en 2010 en correleerde deze met gegevens over antibioticaresistentie van een groot aantal ziekenhuispathogenen. Voor elke 10o C stijging in minimumtemperatuur werd een significantie stijging in resistentie van de onderzochte pathogenen gevonden (4,2%, 2,2% en 2,7% voor respectievelijk E. coli (Escherichia coli), K. pneumoniae en S. aureus) (26). Een vergelijkbare studie over een recentere periode (2000–2016) onderzocht de relatie tussen temperatuur en antibioticaresistentie, verkregen uit surveillancedata van 4 miljoen E. coli-, K. pneumoniae-, S. aureus-isolaten uit 28 Europese landen. Ook hier werd, na correctie voor andere factoren zoals antibioticaconsumptie en bevolkingsdichtheid, een positieve correlatie tussen temperatuur en antibioticaresistentie gevonden. De auteurs concluderen dat stijgende globale temperatuur verspreiding van resistentie kan vergroten en tegenmaatregelen bemoeilijkt (27).
Gevolgen voor verspreidingspatroon en timing infectieziekten
Verder kan klimaatverandering het gebruikelijke verspreidingspatroon en de timing van infectieziekten ten opzichte van het seizoen veranderen. Zo zijn verschillende luchtwegpathogenen, waaronder het influenzavirus, seizoensgebonden in gematigde klimaten en hebben ze in tropische gebieden een meer persistente verspreiding het hele jaar door (28). Klimaatverandering zal naar verwachting leiden tot een uitbreiding van deze tropische patronen, met mogelijke gevolgen voor de evolutie van pathogenen.
Impact op andere wezens
Tot slot zal de impact van klimaatverandering op antimicrobiele resistentie niet alleen gevolgen hebben voor de mens, maar ook voor de gezondheid van andere levende wezens op het land en in het water (25).
Effect op vectoroverdraagbare infectieziekten
Bij vectoroverdraagbare ziekten zijn zowel de vector als de ziekteverwekker gevoelig voor klimaatomstandigheden. Zo neemt de kans op virusoverdracht toe bij hogere temperaturen door het effect op allerlei transmissiegerelateerde levenscycluskenmerken van zowel de mug (steekfrequentie, populatiegrootte en -verspreiding) als de ziekteverwekker (snelheid van vermeerdering in de mug). Daar muggen stilstaand water nodig hebben voor de voorplanting hebben veranderingen in neerslagpatronen effect op muggenpopulaties. Het gevolg hiervan zijn uitbreiding van verspreidingsgebieden van bepaalde vectoren en toename in intensiteit van transmissie van ziekteverwekkers (29). De combinatie van bovenstaande fenomenen, met daarbij de toename van besmette reizigers door toenemende reisbewegingen én prevalentie in endemische gebieden, vergroot zowel de kans op introductie, als de kans op lokale transmissie van arbovirussen (‘arthropod borne’ virussen: door geleedpotigen overgedragen virussen) in Europa (30).
Uitbreiding habitat
Door toenemende handel en de uitbreiding van hun natuurlijk habitat, vestigen exotische muggen zich nu in gebieden die eerder onaangedaan waren. Zo is de Aedes albopictus (tijgermug), vector voor dengue-, chikungunya- en zikavirussen, nu gevestigd in 369 regio's in 16 Europese landen (waaronder België), terwijl dat tien jaar geleden nog maar 114 regio's waren ( 31,32). Importcasussen van arbovirusinfecties kunnen in deze gebieden resulteren in autochtone transmissie. In Europa zijn er in 2025 tot nu toe 27 chikungunya-uitbraken geweest, een nieuw record voor het continent, met tevens een voortdurende noordwaartse uitbreiding van het transmissierisico (31). Hoewel Aedes albopictus in de tropen wordt gezien als een secundaire vector van dengue ten opzichte van Aedes aegypti (33), loopt een toenemend aantal Europese steden een steeds groter risico (34).
Toename overdracht westnijlvirus
Het is echter belangrijk om te beseffen dat de dreiging van muggenoverdraagbare infectieziekten niet alleen van exotische muggen komt. Zo heeft Europa sinds de eeuwwisseling te maken met een gestage toename van het risico op overdracht van het westnijlvirus (WNV). Voorheen onaangetaste regio’s rapporteren lokale transmissie, in 2020 ook Nederland (35). WNV (West Nile virus)-infectie bij de mens wordt veroorzaakt door een beet van een geïnfecteerde Culex pipiens, de in Nederland algemeen voorkomende ‘gewone huismug’. Hoewel de mug inheems is voor Europa, dateren de eerste Europese autochtone besmettingen uit 1996. Toen was er een uitbraak in Roemenië, gevolgd door andere delen in Europa (36). Recent onderzoek met ecologische modellen toonde aan dat de geografische verspreiding van het WNV in Europa, naast veranderingen in landgebruik en bevolkingsdichtheid, beïnvloed is door klimaatverandering (36). De resultaten duiden op een significante uitbreiding van ecologisch gunstige omgevingsomstandigheden voor WNV-overdracht tussen 1901 en 2019, terwijl deze uitbreiding niet zou hebben plaatsgevonden onder een hypothetisch scenario zonder klimaatverandering (36).
Tekenoverdraagbare ziekten
Ook teken en door teken overgedragen ziekten zijn onderhevig aan de effecten van klimaatverandering. De hiermee gemoeide mechanismen zijn echter niet geheel duidelijk. Klimaatverandering kan een direct effect op teken hebben. Zo profiteert de schapenteek van warmere temperaturen door de versnelling van de productie van eitjes en de ei-ontwikkeling, maar verdere stijging van de temperatuur kan de overleving van de teek juist ongunstig beïnvloeden (37). Ook indirect speelt klimaatverandering een rol in de omvang van tekenpopulaties, doordat het de habitat en verspreidingsgebieden beïnvloedt van wilde dieren die als gastheer dienen voor de overdraagbare agens, zoals de Borrelia-bacterie. Daarnaast kan klimaatverandering het infectierisico bij mensen beïnvloeden door verandering in het menselijke gedrag, zoals buitenrecreatie, waarbij mensen activiteiten ondernemen met een mogelijk verhoogde kans op blootstelling aan teken (37). Hoewel in Nederland de incidentie van de ziekte van Lyme in de afgelopen jaren is toegenomen, is het onduidelijk welk aandeel hiervan direct verklaard kan worden door klimaatverandering (4). Dit geldt ook voor tekenencefalitis, een ziekte waarvan het pathogeen net als Lyme door een tekenbeet wordt overgedragen (38). Krim-congo hemorragische koorts, een virusziekte met de Hyalomma marginatum-teek als vector, neemt toe in verschillende endemische gebieden, doordat klimaatverandering het seizoen van de teek verlengt en de geografische expansie vergroot (39).
Effect op wateroverdraagbare infectieziekten
Effect van overstromingen
Klimaatverandering gaat gepaard met het vaker voorkomen van extreme weersomstandigheden zoals extreme regenval. Naarmate de atmosfeer opwarmt, neemt het watervasthoudend vermogen toe. Dit resulteert in een toename van extreme neerslag (7). Overstromingen zijn in Europa daarom de meest voorkomende natuurrampen. Relatief recent, op 14 en 15 juli 2021, vonden er forse overstromingen plaats in Limburg (en in delen van België en Duitsland) na extreme regenbuien, waardoor o.a. het centrum van Valkenburg onder water kwam te staan. Overstromingen kunnen op verschillende manieren wijdverbreide sociale en gezondheidsgevolgen hebben. Deze gevolgen kunnen acuut zijn, of zich pas weken tot maanden na de overstroming manifesteren (40). Zo kunnen overstromingen de infrastructuur en rioleringssystemen verstoren, waardoor het risico op gastro-intestinale infecties toeneemt. Overstromingen vergroten in het algemeen het risico op infecties met virussen zoals norovirus, hepatitis A en rotavirus, met parasieten zoals cryptosporidium, en met bacteriën zoals campylobacter en leptospiren (41,42). Stroomuitval en gebrek aan koeling of kookfaciliteiten vergroten de kans op voedselinfecties, vooral tijdens warme zomers.
Toename Legionella
Toenemende temperatuur in Nederland door klimaatverandering vergroot ook het risico op wateroverdraagbare infectieziekten buiten crisis-/rampsituaties. Weersomstandigheden kunnen bijvoorbeeld de groei en verspreiding van Legionella uit omgevingsbronnen versnellen (43). Infecties in Europa pieken tussen juni en oktober, wat in verband staat met hogere temperaturen. In augustus 2023 werd in Duitsland een toename van Legionella waargenomen, wat verband hield met een relatief hoge luchtvochtigheid bij zomerse temperaturen in de weken daarvoor (44). Het aantal meldingen van in Nederland opgelopen legionellose is de laatste jaren sterk toegenomen. Naar verwachting zal deze stijging de komende jaren doorzetten (45).
Opwarming van de zee en vibrio-infecties
Opwarming van de zeeën en oceanen wordt ook geassocieerd met toename van infectieziekten. Zo neemt de hoeveelheid vibrio-bacterie per volume-eenheid zeewater toe naarmate de zeewatertemperatuur stijgt (46,47). Ook is er meer recreatie in water bij warm weer. Recent is tijdens hittegolven een verheffing gezien van autochtone vibrio-infecties, die soms ernstig verlopen. Deze toename komt voor in landen die grenzen aan de Noordzee en de Oostzee. Deze infecties traden voornamelijk op na blootstelling aan zeewater (48). Stijging van de watertemperatuur, zwemmen in zeewater en het eten van rauwe oesters geven een verhoogd risico op vibrio-besmettingen (47). Bij toename van de zeewatertemperatuur aan de Nederlandse kust is de verwachting dat infecties met de vibrio-bacterie ook zullen toenemen.
Effect op zoönosen en ‘emerging infectious diseases’
Emerging infectious diseases (EID’s) worden gedefinieerd als infectieziekten die nieuw in een populatie voorkomen, of reeds bestaan maar snel toenemen in incidentie of in geografisch bereik. Het grootste gedeelte (75%) van de EID’s betreft zoönosen (49). Wereldwijd zal door klimaatverandering naar verwachting de kans op frequentere en ernstigere epidemieën door deze pathogenen toenemen (50).
Meer leptospirosegevallen
Zo was er in 2014 een uitzonderlijk hoog aantal leptospirosegevallen in Nederland (51). De milde winter van 2013/2014 kan ervoor gezorgd hebben dat meer knaagdieren overleefden. De hogere omgevingstemperaturen kunnen er ook voor gezorgd hebben dat leptospiren die in het oppervlaktewater voorkomen, beter overleefden, en dat er meer recreatiemogelijkheden in het water waren. Dit kan ook de gelijktijdige toename van leptospirosegevallen bij honden verklaren (51). Na deze piek nam het aantal gevallen gradueel af, maar de incidentie in Nederland steeg weer vanaf 2019 (52). Ook in andere Europese landen wordt toename van het aantal leptospirosegevallen gezien (53). Deze trend hangt samen met klimaatverandering, met onder meer stijgende temperatuur en meer neerslag, en kan door de invloed daarvan aanhouden.
Een overzicht van enkele infectieziekten die onder invloed van klimaatverandering in de toekomst in toenemende mate in West-Europa zullen voorkomen, staat in Tabel 1.
| Tabel 1: Enkele actuele en potentiële gezondheidsbedreigingen in West-Europa (4, 30, 41, 54-57). | ||||
| Type infectie | Ziekte of verwekker | Ontwikkeling | Opkomend in NL | |
| Viraal | Tekenencefalitis | Hogere temperaturen lijken de overdracht van het virus te bevorderen | ja | |
| Westnijlkoorts | Snellere transmissiecyclus in mug | ja | ||
| Dengue | Expantie habitat (mug) snellere transmissiecyclus in mug | ja* | ||
| Respiratoire pathogenen | Veranderingen van seizoensgebonden pathogenen, luchtverontreiniging, patientenfctoren | mogelijk | ||
| Bacterieel | Vibrio spp (species). | Opwarming water | ja | |
| Ziekte van Lyme | Tekenseizoen begint eerder; incidentie is afhankelijk van meerdere factoren,het is niet duidelijk wat het aandeel van klimaatverandering hierin is | ** | ||
| Leptospirose | Opwarming water | ja | ||
| Legionellose | Opwarming water | ja | ||
| Parasitair | Cryptosporidiose | Opwarming water | ja | |
| Leishmania | Expantie habitat van de vector (zandvlieg) | nee | ||
| Malaria | Potentiele toename/ expantie van de malariamug/verlenging transmissie seizoen | nee*** | ||
| Fungaal | Candidozyma auris | Antimicrobiele resistentie | ja | |
| * Toename zal mede afhankelijk zijn van o.a. de beschikbaarheid van vaccins en de vaccinatiegraad | ||||
| ** Na aanvankelijk sterke stijging lijkt de incidentie de laatste jaren te stabiliseren. | ||||
| ***Door profylaxe/opsporing/behandeling wordt toename in NL niet verwacht. | ||||
Conclusie
Het overschrijden van de planetaire grenzen, zoals die van klimaatverandering, heeft gevolgen voor de wereldwijde ziektelast door infectieziekten. Bijna 60% van de infectieziekten verergert op enig moment door veranderingen in het klimaat (14). In Nederland zijn de effecten van klimaatverandering op verschillende groepen infectieziekten (wateroverdraagbare, vectoroverdraagbare en zoönotische infectieziekten en EID (Tijdschrift Emerging Infectious Diseases)) al merkbaar. Het is aannemelijk dat de ziektelast door infectieziekten de komende jaren zal toenemen.
De rol van infectieziekteprofessionals in Nederland in het kader van de veranderende planetaire gezondheid verdient verdere aandacht en verdieping. In een mogelijk vervolgartikel beschrijven we graag hoe infectieziekteprofessionals planetary health kunnen integreren in hun dagelijkse werk.
- Rockström J, Steffen W, Noone K, et al. A safe operating space for humanity. Nature. 2009 Sep 24;461(7263):472-5.
- Richardson K, Steffen W, Lucht W, et al. Earth beyond six of nine planetary boundaries. Sci Adv. 2023 Sep 15;9(37):eadh2458.
- Whitmee S, Haines A, Beyrer C, et al. Safeguarding human health in the Anthropocene epoch: report of The Rockefeller Foundation-Lancet Commission on planetary health. Lancet. 2015;386(10007):1973-2028. Erratum in: Lancet. 2015;386(10007):1944.
- C.D. Betgen et al. Gezondheidseffecten van klimaatverandering. Actualisatie van de huidige klimaatrisico's voor gezondheid. RIVM-briefrapport 2023-0324. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2024.
- W. Bil et al. PFAS (Per- en polyfluoralkylstoffen) in bloed van de Nederlandse bevolking. RIVM-briefrapport 2025-0094. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2025.
- Haines A, Ebi K. The imperative for climate action to protect health. N Engl J Med. 2019;380:263–73.
- IPCC (Intergovernmental Panel on Climate Change). Climate Change 2021: The Physical Science Basis. Contribution of Working Group I to the Sixth Assessment Report of the Intergovernmental Panel on Climate Change. 2021.
- Wereld Meteorologische Dag 2024 2024 [Available from: https://www.knmi.nl/over-het-knmi/nieuws/wereld-meteorologische-dag-2024.
- SEI, IISD, ODI, E3G, and UNEP (United Nations Environment Programme). (2021). The Production Gap Report 2021. http://productiongap.org/2021report
- Or Z SA. The role of the health sector in tackling climate change: A narrative review. . Health Policy. 2024;143(105053).
- M.A. Steenmeijer et al.. Verduurzaming van de zorgsector Het effect van de zorgsector op het milieu [Available from: https://www.rivm.nl/duurzamezorg.
- R. Cavicchioli WJR, K.N. Timmis, et al. Scientists’ warning to humanity: microorganisms and climate change. Nat Rev Microbiol 2019;17:569–86.
- Peixoto, R., Voolstra, C.R., Stein, L.Y. et al.Microbial solutions must be deployed against climate catastrophe. Nat Commun. 2024;15:9637.
- Mora C, McKenzie T, Gaw IM, , et al. Over half of known human pathogenic diseases can be aggravated by climate change. Nat Clim Chang. 2022;12:869–75.
- Huynen MM, van Vliet AJ. Klimaatverandering en gezondheid in Nederland. Ned Tijdschr Geneeskd. 2009;153:A1515.
- Quarsie J, van de Pas R, Fanoy E, van den Hazel P. De impact van klimaatverandering op gezondheid in Nederland. Ned Tijdschr Geneeskd. 2021;165:D6245.
- Fernández Salgueiro M CMJ, Gan RK, Arcos González P. Climate change and antibiotic resistance: A scoping review. Environ Microbiol Rep. 2024;16:e70008.
- Seidel L, Broman E, Nilsson E, et al. Climate change-related warming reduces thermal sensitivity and modifies metabolic activity of coastal benthic bacterial communities. ISME J. 2023;17:855-869.
- Kohlenberg A, Monnet DL, Plachouras D; Candida auris survey collaborative group. Increasing number of cases and outbreaks caused by Candida auris in the EU (Europese Unie)/EEA, 2020 to 2021. Euro Surveill. 2022;27:2200846.
- Casadevall A KD, Robert V. On the Emergence of Candida auris: Climate Change, Azoles, Swamps, and Birds. mBio. 2019;10:e01397–19.
- Casadevall A. Immunity to Invasive Fungal Diseases. Annu Rev Immunol. 2022;40:121-141.
- Rzymski P, Gwenzi W, Poniedziałek B, Mangul S, Fal A. Climate warming, environmental degradation and pollution as drivers of antibiotic resistance. Environ Pollut. 2024;346:123649.
- Singer AC (alimentair consulent) SH (small hydrophobic), Rhodes V, et al. Review of antimicrobial resistance in the environment and its relevance to environmental regulators. Front Microbiol. 2016;7:1728.
- Furlan JPR SF, Lincopan N, et al. Catastrophic floods and antimicrobial resistance: interconnected threats with wide-ranging impacts. One Health. 2024;19(100891).
- van Bavel B, Berrang-Ford L, Moon K, Gudda F, et al. Intersections between climate change and antimicrobial resistance: a systematic scoping review. Lancet Planet Health. 2024;8:e1118-e1128.
- MacFadden DR MS (Multiple Sclerose), Fisman D, Santillana M, Brownstein JS (Joint Strike Fighter). Antibiotic Resistance Increases with Local Temperature. Nat Clim Chang. 2018;8:510–4.
- McGough SF MD, Hattab MW, Mølbak K, Santillana M. Rates of increase of antibiotic resistance and ambient temperature in Europe: a cross-national analysis of 28 countries between 2000 and 2016. Euro Surveill. 2020;25:1900414.
- RE Baker, AS Mahmud, IF Miller, M Rajeev, F Rasambainarivo, BL Rice et al. Infectious disease in an era of global change. Nat Rev Microbiol. 2022;20:193–205.
- de Souza WM WS. Effects of climate change and human activities on vector-borne diseases. Nat Rev Microbiol. 2024;22:476–91.
- Knols BGJ, Reinhold W. Exotische muggen in Nederland. Ned Tijdschr Geneeskd. 2023 23;167:D7612.
- ECDC (European Centre for Disease Prevention and Control). Aedes albopictus - current known distribution: June 2025 2025 [Available from: https://www.ecdc.europa.eu/en/publications-data/aedes-albopictus-current-known-distribution-june-2025.
- J Laverdeur, D Desmecht, MP Hayette MP,Darcis G. Dengue and chikungunya: future threats for Northern Europe? Front Epidemiol. 2024;4:1342723.
- ECDC.Aedes Albopicuts - Factsheet for experts. Beschikbaar via: https://www.ecdc.europa.eu/en/disease-vectors/facts/mosquito-factsheets…. Geraadpleegd op 28-08-2025
- ECDC. Dengue risk assessment for mainland EU/EEA 2025 [Available from: https://www.ecdc.europa.eu/en/dengue/surveillance-and-updates/risk-assessment].
- DR Vlaskamp ST, J Reimerink First autochthonous human West Nile virus infections in the Netherlands, July to August 2020. Euro Surveill 2020;25(2001904).
- Erazo D, Grant L, Ghisbain G, Marini G, Colón-González FJ, Wint W et al. Contribution of climate change to the spatial expansion of West Nile virus in Europe. Nature Communications. 2024;15:1196.
- Gilbert L. The Impacts of Climate Change on Ticks and Tick-Borne Disease Risk. Annu Rev Entomol. 2021;66:373-388.
- RIVM. Tekenencefalitis (TBE) [Available from: https://www.rivm.nl/tekenencefalitis]
- Messina JP, Wint GRW. The Spatial Distribution of Crimean-Congo Haemorrhagic Fever and Its Potential Vectors in Europe and Beyond. Insects. 2023 Sep 17;14(9):771.
- Paterson DL WH, Harris PNA. Health Risks of Flood Disasters. Clin Infect Dis. 2018 67:1450–4.
- Limaheluw J SC, Vermeulen-Henstra L, de Roda Husman, AM. Klimaatverandering zal de infectierisico's van wateroverdraagbare infectieziekten beïnvloeden. Ned Tijdschr Med Microbiol 2023;31:54-60.
- Sterk A, Schijven J, de Nijs T, de Roda Husman AM. Direct and indirect effects of climate change on the risk of infection by water-transmitted pathogens. Environ Sci Technol. 2013;47:12648-60.
- G. Klous et al. Staat van infectieziekten in Nederland, 2021. RIVM-Rapport 2022-0141. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2022
- Institute RK. Bei jeglicher Art von Pneumonie differentialdiagnostisch an Legionellen denken. Epidemiolgoisches Bulletin. 2023;34:16.
- D.F.M. Reukers et al. Surveillance van legionellose in Nederland Overzicht van clusters, bronnen en omgevingsfactoren tussen 2013-2022. RIVM-rapport 2024-0036. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2024
- Baker-Austin C TJ, Gonzalez-Escalona N, Martinez-Urtaza J. Non-Cholera Vibrios: The Microbial Barometer of Climate Change. Trends Microbiol 2017;25:76–84.
- Schets FM et al. Risico's van Vibrio-besmetting in zwemwater, schelpdierproductiewater en schelpdieren. RIVM-rapport 2022-0081. Bilthoven: Rijksinstituut voor Volksgezondheid en Milieu, 2023.
- Amato E, Riess M, Thomas-Lopez D, et al. Epidemiological and microbiological investigation of a large increase in vibriosis, northern Europe, 2018. Euro Surveill. 2022;27:2101088.
- Ellwanger JH, Chies JAB. Zoonotic spillover: Understanding basic aspects for better prevention. Genet Mol Biol. 2021;44(1 Suppl 1):e20200355.
- Liao H, Lyon CJ, Ying B, Hu T. Climate change, its impact on emerging infectious diseases and new technologies to combat the challenge. Emerg Microbes Infect. 2024;13:2356143.
- Pijnacker R, Goris MG, Te Wierik MJ, et al. Marked increase in leptospirosis infections in humans and dogs in the Netherlands, 2014. Euro Surveill. 2016;21(17).
- Obels I, Mughini-Gras L, Maas M, et al. Increased incidence of human leptospirosis and the effect of temperature and precipitation, the Netherlands, 2005 to 2023. Euro Surveill. 2025;30(15).
- Beaute J, Innocenti F, Aristodimou A, Spackova M, Eves C, Kerbo N, et al. Epidemiology of reported cases of leptospirosis in the EU/EEA, 2010 to 2021. Euro Surveill. 2024;29(7).
- J.C.Rahamat-Langendoen, J.A.van Vliet en C.B.E.M.Reusken. Klimaatverandering beïnvloedt het vóórkomen in Nederland van ziekten overgebracht door teken, muggen en zandvliegen. Ned Tijdschr Geneeskd. 2008;152:863-8.
- Gregorius J. Sips, Jesse Limaheluw, Ana Maria de Roda Husman en Teun Bousema. Klimaatverandering en infectieziekten wereldwijd. Ned Tijdschr Geneeskd. 2023;167:D7503.
- Bram Goorhuis, Quirijn de Mast, Joppe W. Hovius en Els van Nood. Nieuwe infectieziekten in Europa. De invloed van klimaatverandering, globalisering en menselijk gedrag. Ned Tijdschr Geneeskd. 2023;167:D7675.
- Andersen ZJ, Vicedo-Cabrera AM, Hoffmann B, Melén E. Climate change and respiratory disease: clinical guidance for healthcare professionals. Breathe (Sheff). 2023;19:220222.
Infectieziekten Bulletin - december 2025
- Wonderlijke vragen: Rabiës na een schildpadbeet: feit of fabel?
- Boekje Kan een hoofdluis zwemmen?
- Veranderingen in planetaire gezondheid en de impact ervan op infectieziekten in Nederland
- Proefschriftbespreking: Voorbij de rode lichten: inzicht in de soa-/hiv-ziekenlast en seksuele-gezondheidszorgbehoeften van thuissekswerkers en migrantensekswerkers
- Proefschriftbespreking: Een strategie-op-maat om handhygiëne in verpleeghuizen te verbeteren
- 100 jaar alum - en andere vaccindoorbraken