In februari 2017 gaf de Gezondheidsraad het advies om alle 60-plussers in Nederland een pneumokokkenvaccinatie aan te bieden. Pneumokokken zijn een veel voorkomende verwekker van longontsteking maar ook van infecties als sepsis en meningitis. Er zijn momenteel 2 pneumokokkenvaccins voor oudere volwassenen geregistreerd; een 13-valent pneumokokken conjugaat-vaccin en een 23-valent pneumokokken polysacharide-vaccin. In dit artikel bespreken we het spectrum van infecties veroorzaakt door pneumokokken en hoe vaak deze voorkomen. We gaan in op het effect van invoering van het pneumokokkenconjugaatvaccin voor kinderen in 2006 op het momenteel voorkomen van ziekte bij ouderen. We bespreken de verwachte impact van de verschillende pneumokokkenvaccins bij ouderen. Dit artikel is gebaseerd op het RIVM-rapport ‘Pneumokokkenziekte in Nederland – Achtergronddocument voor de Gezondheidsraad’ (1) en het adviesrapport van de Gezondheidsraad ‘Vaccinatie van ouderen tegen pneumokokken’. (2)
IB april 2019
Auteur: S.Raven
Infectieziekten Bulletin, jaargang 30, nummer 3, april 2019
Pneumokokkenziekte
Streptococcus pneumoniae (pneumokokken) zijn grampositieve diplokokken en frequente commensalen van de bovenste luchtwegen bij de mens. Op basis van het kapsel worden meer dan 90 serotypen van de pneumokok onderscheiden. Kinderen zijn een belangrijke bron voor het verspreiden van pneumokokken in de populatie omdat zij vanwege hun nog onrijpe afweer vaak pneumokokken in de neuskeelholte bij zich hebben (asymptomatisch dragerschap) in hoge densiteit; 60-85% van de kinderen onder de 2 jaar is drager (3-5). Volwassenen en ouderen worden verondersteld weinig aan verspreiding van pneumokokken in de populatie bij te dragen door de lagere prevalentie (vóórkomen) en densiteit (hoeveelheid) van dragerschap.
Soms leidt pneumokokkendragerschap tot ziekte, waarbij we onderscheid maken tussen niet-invasieve pneumokokkenziekte, zoals otitis media, sinusitis, of pneumonie, en invasieve pneumokokkenziekte, zoals sepsis, meningitis en invasieve pneumonie (waarbij de pneumokok in het bloed gevonden wordt).
Pneumokokkenziekte komt het meest voor bij kinderen onder de 2 jaar, en bij ouderen na het 50 levensjaar. Daarnaast is het een bekende bron van infecties bij mensen met een verzwakte afweer of co-morbiditeit. Bij ouderen is pneumonie, al dan niet invasief, verreweg het meest voorkomende ziektebeeld van pneumokokkenziekte. In 2016-2018 was de incidentie van invasieve pneumokokkenziekte in Nederland vijftien per 100.000 personen, wat neerkomt op ~2500 patiënten per jaar, waarvan ruim 1800 60-plussers (6). Deze patiënten worden vrijwel altijd in het ziekenhuis opgenomen. Bij ouderen is het klinisch beeld meestal invasieve pneumonie terwijl bij kinderen veelal sepsis of meningitis wordt gezien.
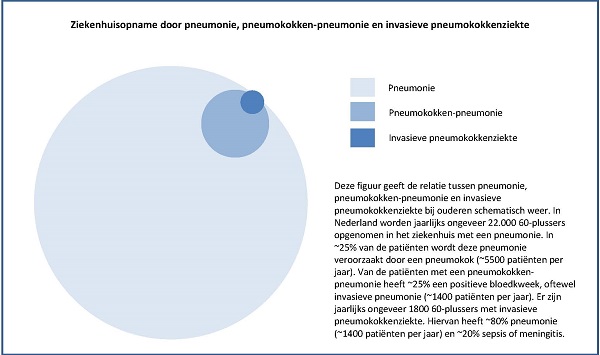
De incidentie van ziekenhuisopnames voor niet-invasieve pneumonie is ongeveer 10 keer zo hoog; in 2012-2014 was dit 188 per 100.000 personen per jaar, wat neerkomt op ongeveer 31.000 met pneumonie opgenomen patiënten per jaar, waarvan ruim tweederde (22.000) bij 60-plussers (1). Het deel van deze pneumonieën dat daadwerkelijk veroorzaakt wordt door pneumokokken, wordt geschat op 20-30% (7-10), wat betekent dat er jaarlijks rond de 7500 patiënten worden opgenomen met pneumokokkenpneumonie, waarvan ongeveer 5500 60-plussers. Pneumonieën gezien door de huisarts worden veel minder vaak door pneumokokken veroorzaakt (figuur 1).
De mortaliteit van pneumokokkenziekte (waarvoor ziekenhuisopname nodig is) bij ouderen is 10-20% (11, 12) en ook de mortaliteit op de lange termijn lijkt hoger te zijn bij mensen die pneumokokkenziekte hebben doorgemaakt (12, 13).
Figuur 1. De relatie tussen ziekenhuisopname door pneumonie, pneumokokken-pneumonie en invasieve pneumokokkenziekte
Effect kinderprogramma op ouderen
In 2006 is een 7-valent pneumokokkenconjugaatvaccin (PCV-7) opgenomen in het Rijksvaccinatieprogramma (RVP) voor zuigelingen op de leeftijd van twee, drie, vier en elf maanden om invasieve pneumokokkeninfecties en longontsteking bij kinderen te voorkomen. De 7 typen in het vaccin waren destijds de meest voorkomende serotypen van invasieve infecties bij kinderen. Sinds 2011 is het 7-valente vaccin vervangen door een 10-valent PCV met 3 additionele serotypen. Na de invoering van PCV7 (pneumokokkenconjugaatvaccin 7) en vervolgens PCV10 (Synflorix®) is invasieve pneumokokkenziekte veroorzaakt door de serotypen in het vaccin sterk afgenomen in gevaccineerde kinderen maar ook in alle ongevaccineerde leeftijdsgroepen, inclusief ouderen (11).
Omdat vaccinatie ook het dragerschap van vaccinserotypen bij kinderen vermindert (14), worden de vaccinserotypen niet langer verspreid naar andere leeftijdsgroepen, waaronder ouderen. Bij kinderen wordt echter de vrijgekomen plaats in dragerschap na verdwijnen van de vaccinserotypen ingenomen door andere serotypen, die op hun beurt nu verspreid worden in de populatie. Het gevolg hiervan is dat ziekte door niet-vaccin serotypen toeneemt. Dit fenomeen is beperkt aanwezig bij jonge kinderen, die minder vaak ziek worden door de vervangende serotypen, maar sterk aanwezig bij ouderen, die ongeacht het serotype meer gevoelig zijn voor ziekte. Ondanks deze typevervanging is er een netto reductie van invasieve pneumokokkenziekte van ongeveer 20% bij ouderen door vaccinatie van kinderen (6, 11). Daarbij is de serotypenverdeling van invasieve pneumokokkenziekte sterk veranderd: voor invoering van PCV7 werd 60-65% van invasieve ziekte bij ouderen veroorzaakt door vaccintypen, terwijl dit nu minder dan 10% is.
Voor niet-invasieve pneumokokkenpneumonie zijn er veel minder gegevens over het effect van kindervaccinatie op de incidentie en serotypenverdeling bij ouderen. Dat komt omdat er bij pneumonie vaak geen diagnostiek verricht wordt naar de verwekker of er geen verwekker gevonden kan worden. Ook serotypering op ander materiaal dan bloed of liquor is lastig en wordt niet vaak gedaan. Een Nederlandse studie heeft echter laten zien dat de effecten van kindervaccinatie op de incidentie en serotypenverdeling van pneumokokkenpneumonie bij ouderen redelijk vergelijkbaar lijken met de effecten op invasieve pneumokokkenziekte (15).
Bescherming van ouderen
De ziektelast van pneumokokkenziekte bij ouderen is dus nog hoog. Volgens de Staat van Infectieziekten 2017 is invasieve pneumokokkenziekte samen met influenza de infectieziekte die de meeste ziektelast veroorzaakt in Nederland, namelijk 9800 Disability Adjusted Life Years (DALYs; een optelsom van verloren gezonde levensjaren door ziekte en invaliditeit en voortijdige sterfte) per jaar (16). Daar is niet-invasieve pneumokokkenpneumonie nog niet in meegenomen dus de werkelijke ziektelast ligt nog vele malen hoger.
Door de Gezondheidsraad zijn verschillende mogelijke vaccinatiestrategieën overwogen om ouderen bescherming te bieden tegen pneumokokkenziekte.
Eén mogelijkheid was om het huidige RVP (Rijksvaccinatie programma) voor kinderen uit te breiden en PCV10 te vervangen door een 13-valent PCV, die 3 extra serotypen bevat, om zo meer indirecte bescherming bij ouderen te krijgen. Recente data uit landen die PCV13 (Prevenar-13®, een geregistreerd 13-valent pneumokokken-conjugaatvaccin) hebben opgenomen in hun nationale vaccinatieprogramma laten echter zien dat de indirecte effecten van de 3 extra serotypen in PCV13 (serotype 3, 6A en 19A) op ouderen beperkt is (17, 18). Er treedt geen indirecte bescherming op tegen serotype 3 en ziekte door serotype 6A komt inmiddels nauwelijks meer voor door kruisbescherming van antistoffen tegen serotype 6B dat in PCV7 en PCV10 zit. De additionele bescherming door PCV13 beperkt zich dus alleen tot ziekte door serotype 19A. Daarnaast neemt ziekte door niet-vaccinserotypen toe door de genoemde vervanging van serotypen in dragerschap. Hierdoor is de verwachting dat er op lange termijn geen netto effect meer is in ouderen door het vaccineren van kinderen met PCV13.
Een andere mogelijkheid is om ouderen zelf te vaccineren met PCV13. De CAPiTA-studie onder 85.000 relatief gezonde Nederlandse volwassenen van 65 jaar of ouder, toonde aan dat PCV13 een effectiviteit heeft van 38% tegen pneumokokkenpneumonie door vaccinserotypen en 76% tegen invasieve pneumokokkenziekte (9), en een duur van bescherming van ten minste 5 jaar. Door invoering van PCV7 en PCV10 in het RVP is echter het aandeel van pneumokokkenziekte dat veroorzaakt wordt door de serotypen in PCV13 sterk gedaald. De te voorkomen ziektelast in de nabije toekomst is daardoor relatief laag. In combinatie met de relatief hoge prijs van PCV13 is de kosteneffectiviteitsratio van PCV13 vaccinatie niet gunstig (19).
Een derde mogelijkheid is om ouderen te vaccineren met een 23-valent pneumokokken-polysacharidevaccin (PPV23), dat bescherming biedt tegen 23 serotypen. In tegenstelling tot een conjugaatvaccin induceert een polysacharidevaccin een T-celonafhankelijke respons, waardoor dit in kinderen onder de 2 jaar niet goed werkt. Ook worden er geen geheugenafweercellen aangemaakt na vaccinatie en daarmee is er geen hogere IgG (Immunoglobulin G)-respons, ‘boosting’, na revaccinatie. PPV23 is al sinds de jaren 80 van de vorige eeuw op de markt, maar het aantal gerandomiseerde studies naar het effect van het vaccin is zeer beperkt en ook zeer heterogeen wat betreft de populatie waarin de studie is uitgevoerd. De beschikbare gegevens laten zien dat PPV23 redelijk goed beschermt tegen invasieve pneumokokkenziekte (geschatte vaccineffectiviteit van 37% over 5 jaar), maar dat het mogelijk minder effectief is tegen pneumokokkenpneumonie dan PCV13 (geschatte vaccineffectiviteit van 7,5% over 5 jaar) (2, 20, 21). De duur van bescherming van PPV23 is korter dan voor PCV13, namelijk maximaal 5 jaar, waardoor herhaling van vaccinatie nodig is. Belangrijk is dat door typevervanging de incidentie van pneumokokkenziekte door de extra serotypen in PPV23 sterk is gestegen in de laatste jaren onder ouderen. Het aantal ziektegevallen veroorzaakt door typen uit PPV23 is hoog en daarmee is de te voorkomen ziektelast door PPV23 relatief hoog. In combinatie met de relatief lagere prijs van PPV23 is de kosteneffectiviteitsratio gunstig (19). De meeste Europese landen adviseren PPV23 voor ouderen (22).
Advies Gezondheidsraad
In februari 2018 bracht de Gezondheidsraad het advies uit om 60-plussers vaccinatie tegen pneumokokken aan te bieden met PPV23 (2). De eerste vaccinatie kan bij 60 jaar plaatsvinden met herhaling op 65-, 70- en 75-jarige leeftijd. De commissie concludeerde dat het nut van de vaccinatie duidelijk opweegt tegen het risico omdat vaccinatie de kans op ziekenhuisopname of sterfte door pneumokokkenziekte vermindert en er aan de vaccinatie zelf nauwelijks risico’s zijn verbonden. De staatssecretaris van Volksgezondheid, Welzijn en Sport heeft in oktober 2018 aangegeven dat hij positief staat tegenover dit advies. Medio 2019 zal besloten worden of hij het advies overneemt en hoe dit zal worden uitgevoerd.
Conclusie
Naar verwachting zal in 2020 pneumokokkenvaccinatie met PPV23 bij ouderen worden geïmplementeerd. Hiermee wordt niet alle ziekte door pneumokokken uitgebannen, maar het kan wel een groot aantal ziekenhuisopnames en sterfgevallen onder ouderen voorkomen. Ervaring met het pneumokokkenconjugaatvaccin bij kinderen heeft laten zien dat pneumokokken zich dynamisch en soms onvoorspelbaar gedragen. Dit maakt dat blijvend monitoren van de serotypenverdeling van (invasieve) pneumokokkenziekte en dragerschap noodzakelijk is, ook nog lange tijd na invoering van nieuwe vaccinaties tegen pneumokokken.
Auteur
M. Knol (1) , H. de Melker (1), A. van der Ende (2) L. Sanders (1,3)
- Centrum voor Infectieziekten bestrijding , RIVM, Bilthoven
- Nederlands Referentielaboratorium voor Bacteriële Meningitis, Amsterdam UMC (Universitair Medisch Centrum)
- Afdeling Kindergeneeskunde, UMC Utrecht
Correspondentie
- Knol MJ, Sanders EAM (Environmental Assessment Module), De Melker HE. Pneumokokkenziekte in Nederland - Achtergronddocument voor de Gezondheidsraad (RIVM rapport 2017-0181). Bilthoven; 2017.
- Gezondheidsraad. Vaccinatie van ouderen tegen pneumokokken. Den Haag: Gezondheidsraad; 2018 28 februari 2018.
- Bogaert D, Sluijter M, Toom NL, Mitchell TJ, Goessens WH, Clarke SC, et al. Dynamics of pneumococcal colonization in healthy Dutch children. Microbiology (Reading, England). 2006;152(Pt 2):377-85.
- Bosch AA, van Houten MA, Bruin JP, Wijmenga-Monsuur AJ, Trzcinski K, Bogaert D, et al. Nasopharyngeal carriage of Streptococcus pneumoniae and other bacteria in the 7th year after implementation of the pneumococcal conjugate vaccine in the Netherlands. Vaccine. 2016;34(4):531-9.
- van Gils EJ, Veenhoven RH, Hak E, Rodenburg GD (Gezondheidsdienst voor Dieren), Bogaert D, Ijzerman EP, et al. Effect of reduced-dose schedules with 7-valent pneumococcal conjugate vaccine on nasopharyngeal pneumococcal carriage in children: a randomized controlled trial. JAMA (Journal of the American Medical Association). 2009;302(2):159-67.
- The National Immunisation Programme in the Netherlands - Surveillance and developments in 2017-2018 (RIVM report 2018-0124). Bilthoven; 2018.
- Rozenbaum MH, Pechlivanoglou P, van der Werf TS, Lo-Ten-Foe JR, Postma MJ, Hak E. The role of Streptococcus pneumoniae in community-acquired pneumonia among adults in Europe: a meta-analysis. European journal of clinical microbiology & infectious diseases : official publication of the European Society of Clinical Microbiology. 2013;32(3):305-16.
- van Gageldonk-Lafeber AB, Wever PC, van der Lubben IM, de Jager CP, Meijer A, de Vries MC (medisch centrum), et al. The aetiology of community-acquired pneumonia and implications for patient management. The Netherlands journal of medicine. 2013;71(8):418-25.
- Bonten MJ, Huijts SM, Bolkenbaas M, Webber C, Patterson S, Gault S, et al. Polysaccharide conjugate vaccine against pneumococcal pneumonia in adults. The New England journal of medicine. 2015;372(12):1114-25.
- Raeven VM (Verkennende Monitoring), Spoorenberg SM, Boersma WG, van de Garde EM, Cannegieter SC, Voorn GP (general practitioner), et al. Atypical aetiology in patients hospitalised with community-acquired pneumonia is associated with age, gender and season; a data-analysis on four Dutch cohorts. BMC infectious diseases. 2016;16:299.
- Wagenvoort GH, Sanders EA, Vlaminckx BJ, Elberse KE, de Melker HE, van der Ende A, et al. Invasive pneumococcal disease: Clinical outcomes and patient characteristics 2-6 years after introduction of 7-valent pneumococcal conjugate vaccine compared to the pre-vaccine period, the Netherlands. Vaccine. 2016;34(8):1077-85.
- Wagenvoort GH, Sanders EA, de Melker HE, van der Ende A, Vlaminckx BJ, Knol MJ. Long-term mortality after IPD (invasieve pneumokokkenziekte) and bacteremic versus non-bacteremic pneumococcal pneumonia. Vaccine. 2017;35(14):1749-57.
- Mangen MJ, Huijts SM, Bonten MJ, de Wit GA. The impact of community-acquired pneumonia on the health-related quality-of-life in elderly. BMC infectious diseases. 2017;17(1):208.
- Vissers M, Wijmenga-Monsuur AJ, Knol MJ, Badoux P, van Houten MA, van der Ende A, et al. Increased carriage of non-vaccine serotypes with low invasive disease potential four years after switching to the 10-valent pneumococcal conjugate vaccine in The Netherlands. PLoS (Plos One) One. 2018;13(3):e0194823.
- van Werkhoven CH (Congenitale hypothyreoidie), Hollingsworth RC, Huijts SM, Bolkenbaas M, Webber C, Patterson S, et al. Pneumococcal conjugate vaccine herd effects on non-invasive pneumococcal pneumonia in elderly. Vaccine. 2016;34(28):3275-82.
- Staat van infectieziekten in Nederland 2017 (RIVM rapport 2018-0032). Bilthoven; 2018.
- Hanquet G, editor Indirect effects of five years of infant PCV10 (Synflorix®)/13 vaccination on invasive pneumococcal disease among the elderly: pooled analysis from 10 European countries. ESCAIDE; 2016; Stockholm.
- Ladhani SN, Collins S, Djennad A, Sheppard CL, Borrow R, Fry NK, et al. Rapid increase in non-vaccine serotypes causing invasive pneumococcal disease in England and Wales, 2000-17: a prospective national observational cohort study. The Lancet infectious diseases. 2018;18(4):441-51.
- Thorrington D, van Rossum L, Knol M, de Melker H, Rumke H, Hak E, et al. Impact and cost-effectiveness of different vaccination strategies to reduce the burden of pneumococcal disease among elderly in the Netherlands. PLoS One. 2018;13(2):e0192640.
- Falkenhorst G, Remschmidt C, Harder T, Hummers-Pradier E, Wichmann O, Bogdan C. Effectiveness of the 23-Valent Pneumococcal Polysaccharide Vaccine (PPV23) against Pneumococcal Disease in the Elderly: Systematic Review and Meta-Analysis. PLoS One. 2017;12(1):e0169368.
- Moberley S, Holden J, Tatham DP, Andrews RM (risicomanagement). Vaccines for preventing pneumococcal infection in adults. The Cochrane database of systematic reviews. 2013;1:Cd000422.
- ECDC (European Centre for Disease Prevention and Control). Vaccine schedule [Available from: http://vaccine-schedule.ecdc.europa.eu/Pages/Scheduler.aspx.
Infectieziekten Bulletin april 2019
- Gesignaleerd
- Wat vinden vrouwen van de maternale kinkhoestvaccinatie?
- Meldingen in de virologische weekstaten tot en met week 12, 2019
- Meldingen Wet publieke gezondheid tot en met week 12, 2019
- Surveillance van mogelijke bijwerkingen na HPV-vaccinatie: het vaccin is veilig
- Interview: Meer eisen dan mogelijk
- Vaccinatieprogramma in Nederland: de impact op de publieke gezondheid
- Storytelling over vaccinatie: moeilijkheden en mogelijkheden
- Overwegingen bij vaccinaties van inwoners regio Zuid-Holland Zuid
- Rabiës PEP na slijmvliescontact
- Vervroegde extra BMR-vaccinatie tijdens een mazelenuitbraak
- Vermindering van fouten bij vaccinbereiding; een kwestie van techniek of vakmanschap?
- Waterpokkenvaccinatie als postexpositieprofylaxe
- Bescherming tegen hepatitis B bij werkgerelateerde besmettingsaccidenten
- Pasgeborenen voorop
- Griepvaccinatie in Ziekenhuis Amstelland
- Ervaringen met gordelroosvaccinatie in Nederland
- Pneumokokkenvaccinatie voor ouderen
- Inzicht in respiratoir syncytieel virus in jonge kinderen
- Bofuitbraken onder jongvolwassenen
- Over Infectieziekten Bulletin