Voedsel kan besmet zijn met ziekteverwekkende micro-organismen (pathogenen): bacteriën, schimmels, parasieten en/of virussen. De mate van ziekmakend vermogen (virulentie) verschilt van organisme tot organisme, maar ook van stam tot stam en zelfs de omgeving van het pathogeen kan daar op van invloed zijn. Dit artikel gaat over het gebruik van een experimenteel maagdarmsysteem en daarvan afgeleide systemen, voor het bepalen van de relatieve virulentie van bacteriële voedselpathogenen. Informatie over relatieve virulentie is van belang voor Kwantitatieve Microbiële Risicoschatting (QMRA): een methode om het relatieve ziekterisico voor consumenten te bepalen op het moment dat er bacteriële pathogenen in voedselproducten en/of productie-omgevingen worden gevonden.
Infectieziekten Bulletin - 08/2022
Auteurs: L.M. Wijnands, A.H.A.M. van Hoek , I.L. Bergval, E. Benincà, E.G. Evers
Infectieziekten Bulletin augustus 2022
Bij bacteriële voedselpathogenen bestaan verschillende mechanismen die tot ziekte leiden:
1) voedselinfecties, veroorzaakt door de bacterie zelf;
2) voedselintoxicaties, veroorzaakt door toxinen die in het voedsel zijn geproduceerd door de bacterie;
3) toxico-infecties, veroorzaakt door toxinen die door de bacterie in de darm worden geproduceerd.
Voor sommige voedselinfecties veroorzakende bacteriën is het aangrijpingspunt het intestinale epitheel zelf (bijvoorbeeld Campylobacter jejuni), andere pathogenen moeten door de intestinale epitheellaag heen om ziekte te kunnen veroorzaken (bijvoorbeeld Listeria monocytogenes). Salmonella-soorten kunnen zowel ziekte verwekken na aangrijpen op de epitheelcellen, alsook na passage door de epitheellaag. Bij voedselintoxicaties worden toxinen door de bacteriën in of op het voedsel geproduceerd. Voorbeelden zijn Staphylococcus aureus-enterotoxinen en -cereulide geproduceerd door Bacillus cereus (braaktype). Bij toxico-infecties bereiken bacteriën levend de darm, om daar uit te groeien en enterotoxinen te produceren, die vervolgens tot ziekte leiden. Voorbeelden zijn Bacillus cereus (diarreetype), Clostridium perfringens en shigatoxineproducerende Escherichia coli (STEC).
Er zijn diverse methoden om de virulentie van een voedselpathogeen te bepalen, elk met voor- en nadelen. Het blootstellen van proefpersonen of proefdieren aan verschillende aantallen van een ziekteverwekker heeft bijvoorbeeld een laag abstractieniveau (i.e. ligt dicht bij de realiteit) en zou een natuurlijke besmetting het meest benaderen. Voor deze methode zijn echter veel proefpersonen en proefdieren nodig om tot betrouwbare resultaten te komen. Daarnaast zijn de resultaten door het gebruik van alleen gezonde proefpersonen of proefdieren waarvan het maagdarmstelsel en immuunsysteem minder goed overeenkomen met de situatie in de mens, niet altijd direct te extrapoleren. Bovendien worden deze experimenten als onethisch beschouwd.
Om onafhankelijk te zijn van proefpersonen of proefdieren wordt de laatste decennia steeds vaker gebruik gemaakt van modelsystemen, bijvoorbeeld met (humane) cellen, waarin het virulentiemechanisme wordt nagebootst. Gastheercellijnen, zoals gedifferentieerde Caco-2-cellen1, zijn eenvoudig beschikbaar en door de relatieve eenvoud van de systemen is de reproduceerbaarheid hoog. Nadeel van dit soort systemen is dat het incomplete modellen van de werkelijkheid zijn waardoor ze verder van de realiteit verwijderd zijn.
Dit artikel gaat over het gebruik van een experimenteel maagdarmsysteem en daarvan afgeleide systemen met gedifferentieerde Caco-2-cellen als model voor epitheelcellen van de dunne darm, voor het bepalen van de relatieve virulentie van bacteriële voedselpathogenen.
1Caco-2-cellen zijn humane carcinoomcellen van de dikke darm. Het is echter mogelijk om ze, door ze circa 2 weken alleen te voeden, te differentiëren tot cellen die model staan voor epitheelcellen van de dunne darm, de porte d’entrée voor bacteriële voedselpathogenen.
In-vitro-methode
De belangrijkste methode die is gebruikt voor de vergelijking van virulentie van bacteriële voedselpathogenen is het in vitro gastro-intestinaal modelsysteem GIT (Gastro Intestinal Tract) inclusief de interactie van de bacteriën met de epitheelcellen van de dunne darm. (1)
In dit systeem (figuur 1) wordt een deel van een reine overnachtcultuur2 van een voedselpathogeen toegevoegd aan synthetisch (gesimuleerd) maagsap. Na incubatie (30 minuten, 37 °C) wordt een deel van dit mengsel toegevoegd aan kunstmatig (gesimuleerd) darmsap. Na wederom een incubatie (2 uur, 37 °C) wordt een deel van de laatste vloeistof toegevoegd aan gedifferentieerde Caco-2-cellen in 12-wells celcultuurplaten.
Figuur 1. Gastro-intestinaal modelsysteem inclusief interactie met intestinale cellen, het GIT (Gastro Intestinal Tract)-systeem). Zie uitleg in tekst onder In-vitro-methode
In deze stap worden zowel adhesie aan, als ook invasie in de epitheelcellen bepaald (in duplo). Uiteindelijk wordt voor iedere gebruikte stam de kans op adhesie en/of invasie per bacteriecel bepaald door het aantal levensvatbare geïnvadeerde bacteriën te vergelijken met het aantal levensvatbare bacteriën waarmee het experiment wordt gestart, rekening houdend met de verdunningsstappen in het systeem (Intermezzo).
Van het GIT-systeem zijn ook afgeleiden gebruikt, waarbij uitsluitend gebruik gemaakt wordt van gedifferentieerde Caco-2-cellen in 12- of 24-wellsplaten (figuur 2A), of op inserts van zogenoemde Transwellplaten, in een 12- of 24-wellssysteem (figuur 2B). De focus ligt daarbij meestal op het bepalen van de interactie van pathogenen met de gastheercellen, een belangrijke indicator van de relatieve virulentie. In het systeem weergegeven in figuur 2B, is het mogelijk om in het onderste compartiment te kijken of en, zo ja, in welke mate bacteriën door de epitheel monolaag zijn verplaatst. Voor zowel het conventionele - als het Transwellsysteem geldt dat het aantal geïnvadeerde respectievelijk verplaatste bacteriën vergeleken wordt met het aantal waarmee is gestart.
2Er wordt van uit gegaan dat in een overnachtcultuur alle bacteriën zich in de stationaire, en dus dezelfde, fase bevinden
Figuur 2. Afgeleide celsystemen. A. conventioneel systeem, B: Transwellsysteem
De toxiciteit van toxinen gevormd door voedselpathogenen en leidend tot intoxicaties of toxico-infecties, wordt uitgevoerd met de methode die weergegeven is in figuur 2A. Hierbij wordt gewerkt met VERO3-of HEp24-cellen in plaats van gedifferentieerde Caco-2-cellen. Er worden geen bacteriën aan het systeem toegevoegd, maar een cultuurextract met daarin mogelijk de door de bacteriën geproduceerde toxinen. Deze toxinen tasten de cellen aan, waarbij de mate van aantasting een maat is voor de potentie en concentratie van het aanwezige toxine.
3VERO-cellen zijn epitheelcellen afkomstig van de nier van de Afrikaanse groene aap
4Hep2-cellen zijn kanker cellen afkomstig van een humaan epidermidis carcinoom
Intermezzo
Bij microbiologische risicoschatting (Quantitative Microbiological Risk Assessment, QMRA (Quantitative microbial risk assessment)) wordt virulentie beschreven met een wiskundig model, een zogenoemd dosisresponsmodel, waarbij de respons dragerschap of ziekte kan zijn. (2). Er zijn diverse dosisresponsmodellen, maar het basisidee is dat de kans op een respons (bijvoorbeeld ziekte) toeneemt naarmate het aantal ingeslikte bacteriën (de dosis) op een blootstellingsmoment groter is. Een belangrijke parameter in deze modellen is de (veelal heel kleine) kans dat ingestie van 1 bacteriecel tot een respons leidt. De waarde van deze parameter kan met behulp van GIT-experimenten geschat worden voor individuele bacteriestammen, maar heeft alleen betekenis in vergelijking met andere bacteriestammen.
Resultaten
Salmonella is 1 van de meest onderzochte bacteriën met het GIT-systeem (Figuur 1). Hiervoor zijn isolaten uit een Nederlandse verzameling gebruikt, behorend tot verschillende serovars en met verschillende herkomst (humaan, kip en kipproducten). Bij alle experimenten is 1 Salmonella-Typhimurium-stam als referentie gebruikt. De resultaten zijn beschreven door Pielaat et al. (3) en Kuijpers et al. (4). Naast het onderzoek met het GIT-systeem is gekeken naar de aanwezigheid van een groot aantal virulentiegenen, om te onderzoeken of de (in-vitro-) virulentie voorspeld kan worden met het virulentieprofiel (aan- en afwezigheid van virulentiegenen). De resultaten voor de GIT- experimenten waren echter niet direct gecorreleerd aan de virulentieprofielen, waardoor de voorspellende waarde relatief laag is. Vergelijkbare experimenten zijn uitgevoerd met omgevingsisolaten uit Canada en isolaten uit Italië (humaan, dierlijk en voedsel).
Bij de Canadese isolaten kon geen directe correlatie worden aangetoond tussen de virulentieprofielen en de resultaten van de GIT-experimenten.
Bij de Italiaanse isolaten zijn geen statistisch significante verschillen gevonden tussen stammen of herkomst van de stammen voor wat betreft de kans op invasie (=het aantal bacteriën dat de Caco-2-cellen binnendringt gedeeld door het aantal bacteriën bij aanvang van het GIT-experiment).
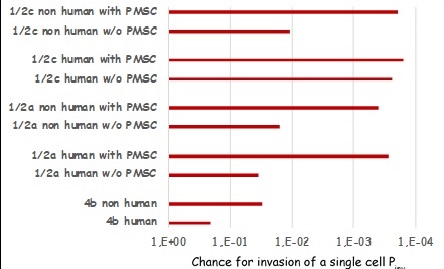
Met Listeria monocytogenes (Lm)-stammen zijn onderzoeken uitgevoerd in opdracht van de Nederlandse Voedsel- en Warenautoriteit (NVWA). Met het GIT-systeem is de in-vitro-virulentiecapaciteit tussen stammen van verschillende Lm-serotypen vergeleken (hier uitgedrukt als Pinv, de kans voor 1 enkele bacteriecel op invasie in gedifferentieerde Caco-2-cellen) (niet gepubliceerde resultaten, figuur 3). Hoewel er nog geen statistische berekeningen zijn verricht ter onderbouwing, kan duidelijk onderscheid gemaakt worden tussen virulentie van de verschillende serotypen. Deze verschillen komen overeen met gegevens uit de literatuur over virulentieverschillen tussen de verschillende serotypen.
Uit een andere onderzoekslijn, waarbij non-humane Lm-isolaten (serotype 1/2a) uit een reeds lang bestaande verzameling zijn vergeleken met verse voedselisolaten met hetzelfde serotype 1/2a, bleek dat de gemiddelde virulentie van de verse isolaten hoger was dan die van de isolaten uit de cultuurverzameling. Langdurige opslag van isolaten kan dus een nadelig effect hebben op de virulentie; een fenomeen dat invloed kan hebben op de resultaten van experimenten.
In samenwerking met de Leerstoelgroep Levensmiddelenmicrobiologie van Wageningen Universiteit en Research (WUR), zijn in verschillende onderzoeken varianten van Lm- stammen gebruikt. In 2 varianten van stam LO28 met verhoogde stressbestendigheid, blijken genen die onder controle staan van het Sigma-B-stressregulatie-eiwit , te zijn geactiveerd. Hieronder Internaline A en Internaline B, die beide betrokken zijn bij de adhesie van Lm-cellen aan epitheelcellen van de dunne darm. In in-vitro-experimenten bleken beide varianten inderdaad een hogere adhesie aan gedifferentieerde Caco-2-cellen te vertonen. De in-vitro-virulentie-experimenten bevestigen zodoende de bevindingen uit de moleculaire data. (5-7)
In experimenten met varianten van Lm-EGDe is gekeken naar het rhamnosegebruik onder anaerobe omstandigheden. Rhamnose is in grote mate voorhanden in de darm van de mens (anaerobe omstandigheden) en wordt door darmbacteriën omgezet in onder andere 1,2-propanediol (Pd). Anaeroob, vitamine B12-afhankelijk metabolisme van rhamnose en Pd wordt in verband gebracht met virulentie van enterale pathogenen, waaronder Salmonella en Lm . (8) Inductie van rhamnose en Pd-verbruik door de toevoeging van vitamine B12 aan Lm-cultures onder anaerobe omstandigheden, resulteert in hogere in-vitro-translocatie-efficiency van Lm-cellen dan wanneer aerobe omstandigheden werden toegepast (met of zonder vitamine B12-stimulatie) [9]. De relatie tussen (vitamine-B12-afhankelijk) substraatmetabolisme en virulentie van Lm dient verder te worden onderzocht.
In verschillende experimenten met Enterococcus faecium, dat onder andere urineweginfecties veroorzaakt, is onderzoek gedaan naar de aanhechting van wildtype en mutanten van E. faecium aan gedifferentieerde Caco-2-cellen en andere epitheelcellijnen. Doel van deze experimenten was om na te gaan of de (gemuteerde) genen een rol spelen bij de aanhechting aan epitheelcellen en daarmee een bijdrage leveren aan ziekte veroorzaakt door E. faecium. (10-12)
Figuur 3. Vergelijking van de kans op invasie per individuele bacteriecel (Pinv)tussen verschillende serotypen van L. monocytogenes met verschillende herkomst (humaan versus niet humaan) en met (w) en zonder (w/o) een prematuur stop codon (PMSC) in het Internaline-A gen (inlA).
Het onderzoek met Bacillus cereus werd uitgevoerd met enterotoxineproducerende stammen die verantwoordelijk zijn voor het diarreesyndroom. In kunstmatig darmsap is met een cytotoxiciteitstest met VERO-cellen (figuur 2A) gekeken naar de stabiliteit van enterotoxinen. Hieruit bleek dat de omstandigheden in dit sap niet geschikt zijn om stabiliteit van de enterotoxinen te realiseren. (13). Om toch ziekte te kunnen veroorzaken moeten B. cereus-cellen zich blijkbaar hechten aan (de mucinelaag van) het dunnedarmepitheel, waar gedifferentieerde Caco-2-cellen model voor staan in het GIT-systeem. Op die manier worden enterotoxinen direct bij de epitheelcellen geproduceerd en niet geïnactiveerd door darmsap, zodat ze alsnog de epitheelcellen (of gedifferentieerde Caco-2-cellen) kapot kunnen maken. Zo is te verklaren dat diarree ontstaat als gevolg van inname van B. cereus. (13)
Dat niet alle bacteriële voedselpathogenen zich lenen voor onderzoek in dit GIT-systeem werd duidelijk door experimenten met (pathogene) E. coli-stammen. Vergelijking van adhesie/invasie van verschillende shigatoxineproducerende E. coli (Escherichia coli)-stammen (STEC) liet geen significant verschil zien tussen de stammen, terwijl uit epidemiologische gegevens naar voren kwam dat er wel degelijk verschillen in ziekmakend vermogen bestond tussen de gebruikte stammen (niet gepubliceerde resultaten). Evenmin werden in het GIT-systeem verschillen gevonden tussen pathogene E. coli- stammen enerzijds en niet-pathogene antibioticumresistente E. coli-stammen anderzijds.
Het hier beschreven afgeleide systeem voor bepaling van adhesie en invasie is niet alleen gebruikt voor voedselpathogenen, maar in iets aangepaste vorm ook voor immunologisch onderzoek. Onderzoek van lichaamsmaterialen van patiënten met en zonder Influenza Like Illness (ILI) lieten activatie van bepaalde cytokinen zien onder invloed van een ziekteverwekkend organisme en een specifieke commensale bacterie, Ruminococcus torques. Met behulp van gedifferentieerde Caco-2-cellen (in een in-vitro-setting als weergegeven in figuur 2A), R. torques en een pathogene E. coli (attaching and invading E. coli, AIEC) werd activatie gezien van dezelfde cytokinen als in de patiëntmonsters. Hieruit blijkt dat het gebruik van gedifferentieerde Caco-2-cellen als model voor intestinale epitheelcellen breder toepasbaar is dan alleen voor de bepaling van invasief vermogen van pathogene voedselbacteriën. (14)
Evaluatie
Het GIT-systeem is een sequentieel statisch model waarbij de meest karakteristieke omstandigheden tijdens gastro-intestinale passage van bacteriën worden gesimuleerd; blootstelling aan synthetisch maag- en vervolgens darmsap en tenslotte aan intestinale epitheelcellen. Doordat de (overlevende) bacteriën direct van de ene conditie naar de volgende conditie worden overgebracht, zonder tussentijdse kweek, zijn blootstellingen aan eerdere condities (en eventuele aanpassingen daaraan van de bacteriën) direct van invloed op latere fasen. Door het statische karakter van het systeem worden dynamische aspecten, zoals de opname van voedsel, of de dynamiek van de pH in het maagsap, niet in beschouwing genomen. Verder wordt in het darmgedeelte geen onderscheid gemaakt in de verschillende delen van de dunne darm en/of verschillen in galconcentraties, zoals bij de mens aan de orde is. Dynamiek in het systeem zou leiden tot een veel complexer systeem met eindeloze variatiemogelijkheden (15), met mogelijk realistischer resultaten maar ook verlaagde reproduceerbaarheid. Echter, 1 van de uitgangspunten van het beschreven GIT-model is een relatief snelle vergelijking van de virulentie van verschillende bacteriestammen.
Doordat met het hier gepresenteerde systeem meerdere stammen in 1 experiment onderzocht kunnen worden, kan de in-vitro-virulentie van die stammen ten opzicht van elkaar worden bepaald. Het systeem is, in zijn huidige vorm, ongeschikt voor absolute bepaling van in-vivo-virulentie. De onderzoeksresultaten bieden echter wel uitstekende perspectieven voor verbetering en/of verfijning van kwantitatieve risicoschattingen met betrekking tot bacteriële voedselpathogenen. Resultaten van onderzoek van Salmonella-stammen in het GIT-systeem in combinatie met moleculaire data van diezelfde stammen worden al gebruikt om na te gaan hoe risicoschattingen verbeterd zouden kunnen worden (resultaten nog niet gepubliceerd).
Het gebruik van gedifferentieerde Caco-2-cellen als model voor epitheelcellen van de dunne darm maakt dat het hier beschreven GIT-systeem complementaire informatie levert ten opzichte van systemen die deze cellen niet hebben, zoals TIM (Tweede Immunisatie MenC) -1, ontwikkeld door TNO-Voeding, of het SHIME -systeem, ontwikkeld aan de Universiteit van Gent. (15, 16)
Toekomstperspectieven
Vanwege de eenvoudige maar robuuste opzet biedt het GIT-systeem zoals hier beschreven zeker nog ruimte voor aanpassing en uitbreiding, bijvoorbeeld om de verkregen resultaten toch meer aan de in-vivo-situatie te kunnen relateren. Uit onderzoek is naar voren gekomen dat in de 12-well-platen met Caco-2-cellen ook bacteriën van verschillende genera tegelijk in 1 well kunnen worden toegevoegd. (14) Zo is het mogelijk om meer onderzoek naar de interactie tussen gastheercellen en kleine microbioomsystemen als aanzet voor uitgebreider microbioomonderzoek. Aangezien ook is aangetoond dat experimenten met gedifferentieerde Caco-2-cellen onder verlaagde zuurstofspanning tot anaeroob kunnen worden uitgevoerd (6,7,14), kan de realiteit (de vrijwel anaerobe omstandigheden in de dunne darm) nog meer benaderd worden. Dit zou niet alleen zijn weerslag hebben op onderzoek met voedselpathogenen die alleen maar onder verlaagde zuurstofspanning kunnen groeien, zoals Campylobacter jejuni, maar ook op microbioomonderzoek.
Het hier gepresenteerde GIT-systeem kan alleen en/of samen met moleculaire technieken (omics) een waardevolle bijdrage leveren aan het verfijnen/verbeteren van de kwantitatieve schatting van risico’s voor consumenten na het aantreffen van bacteriële voedselpathogenen in consumentenproducten en/of productieomgevingen. Het GIT-systeem wordt dan als functionele assay ingezet om de veranderingen in virulentie in relatie tot (of als gevolg van) diverse moleculaire markers te bepalen.
Verder uitwerken van het Transwellsysteem (figuur 2B), met bijvoorbeeld effectorcellen zoals VERO-cellen voor de detectie van bacteriële toxinen aan de basolaterale zijde van het systeem, zou verder onderzoek met bijvoorbeeld STEC (Shigatoxineproducerende E. coli-stammen)-stammen mogelijk maken. Shigatoxines zijn immers verantwoordelijk voor ernstige ziektesymptomen bij besmetting met STEC.
Tenslotte zou validatie van het GIT-systeem door vergelijking met in-vivo-resultaten de bruikbaarheid enorm vergroten. Tot op heden is echter door de beperkte beschikbaarheid van uitbraakgegevens (met name concentraties van het pathogeen in het voedsel) en/of uitbraakstammen een dergelijke validatie nauwelijks mogelijk gebleken.
Het hier beschreven GIT-systeem plus de afgeleide methoden vormen waardevolle in-vitro-modellen voor de vergelijking van het ziekmakend vermogen van stammen van bacteriële voedselpathogenen. Recent is gebleken dat het ook geschikt is voor modelonderzoek in de immunologie. Voor de eerstgenoemde toepassing is het GIT-systeem uitgebreid en succesvol benut door de afdeling Zoönosen en Omgevingsmicrobiologie van het RIVM en de Leerstoelgroep Levensmiddelenmicrobiologie van WUR (Wageningen University &Research); voor de immunologische toepassing is het gebruikt door de afdelingen Zoönosen en Omgevingsmicrobiologie en Immunologie en Infectieziekten en Vaccins van het RIVM.
Erkentelijkheid
Alle mensen die hebben meegewerkt aan het tot stand komen van het hier beschreven GIT-systeem en afgeleide methoden, en aan de aansluitende experimenten, worden hiervoor hartelijk bedankt.
Verantwoording
Een deel van het hier beschreven onderzoek is uitgevoerd in opdracht van de Nederlandse Voedsel- en Warenautoriteit (NVWA).
Auteurs
L.M. Wijnands, A.H.A.M. van Hoek , I.L. Bergval, E. Benincà, E.G. Evers
Correspondentie
- Wijnands, L.M., et al., Quantification of Salmonella survival and infection in an in vitro model of the human intestinal tract as proxy for foodborne pathogens. Frontiers in Microbiology, 2017. 8(JUN).
- Teunis, P.F.M., et al., Dose-response modeling of Salmonella using outbreak data. International Journal of Food Microbiology, 2010. 144(2): p. 243-249.
- Pielaat, A., et al., Phenotypic behavior of 35 Salmonella serovars compared to epidemiological and genomic data. Procedia Food Science, 2016. 7: p. 53-58.
- Kuijpers, A.F.A., et al., Phenotypic Prediction: Linking in vitro Virulence to the Genomics of 59 Salmonella enterica Strains. Frontiers in Microbiology, 2019. 9(3182).
- Koomen, J., et al., Gene profiling-based phenotyping for identification of cellular parameters that contribute to fitness, stress-tolerance and virulence of Listeria monocytogenes variants. International Journal of Food Microbiology, 2018. 283: p. 14-21.
- Zeng, Z., et al., Impact of vitamin B12 on rhamnose metabolism, stress defense and in-vitro virulence of <em>Listeria monocytogenes</em>. bioRxiv, 2021: p. 2021.08.26.457850.
- Zeng, Z., et al., Impact of bacterial microcompartment-dependent ethanolamine and propanediol metabolism on <em>Listeria monocytogenes</em> interactions with Caco-2 cells. bioRxiv, 2021: p. 2021.08.26.457845.
- Jakobson, C.M. and D. Tullman-Ercek, Dumpster Diving in the Gut: Bacterial Microcompartments as Part of a Host-Associated Lifestyle. PLoS (Plos One) Pathogens, 2016. 12(5).
- Zeng, Z., et al., Bacterial microcompartments in food-related microbes. Current Opinion in Food Science, 2022. 43: p. 128-135.
- Heikens, E., et al., Enterococcal surface protein Esp is not essential for cell adhesion and intestinal colonization of Enterococcus faecium in mice. BMC Microbiology, 2009. 9.
- Hendrickx, A.P.A., et al., SgrA, a nidogen-binding LPXTG surface adhesin implicated in biofilm formation, and EcbA, a collagen binding MSCRAMM, are two novel adhesins of hospital-acquired Enterococcus faecium. Infection and Immunity, 2009. 77(11): p. 5097-5106.
- Leendertse, M., et al., Enterococcal surface protein transiently aggravates enterococcus faecium-induced urinary tract infection in mice. Journal of Infectious Diseases, 2009. 200(7): p. 1162-1165.
- Wijnands, L., Caco-2 cell surface associated growth of enterotoxic Bacillus cereus is a prerequisite for initiation of cytotoxic effects in simulated intestinal fluid, in Bacillus cereus associated food borne disease: quantitative aspects of exposure assessment and hazard characterization. 2008, WUR (Wageningen University &Research): Wageningen, The Netherlands. p. 95-108.
- Fuentes, S., et al., Associations of faecal microbiota with influenza-like illness in participants aged 60 years or older: an observational study. The Lancet Healthy Longevity, 2021. 2(1): p. e13-e23.
- Van de Wiele, T., et al., The Simulator of the Human Intestinal Microbial Ecosystem (SHIME®), in The Impact of Food Bio-Actives on Gut Health, K. Verhoeckx, et al., Editors. 2015, Springer International Publishing AG.
- Minekus, M., The TNO Gastro-Intestinal Model (TIM), in The Impact of Food Bio-Actives on Gut Health, K. Verhoeckx, et al., Editors. 2015, Springer International Publishing AG.
Infectieziekten Bulletin - augustus 2022
- Drie onderzoeken over SARS-CoV-2 op basisscholen
- De rol van kinderen bij de verspreiding van SARS-CoV-2 tijdens een uitbraak op een basisschool in Twente
- Weinig SARS-CoV-2-transmissie op 18 basisschoolklassen tijdens de alphavariant
- Niet-farmacologische interventies tegen transmissie van SARS-CoV-2 op basisscholen in Zuid-Limburg
- COVID-19-uitbraken in verpleeghuizen : besmettingskans, ernst en vaccineffectiviteit
- Clusters van MRSA en andere BRMO in de thuiszorg
- Modelsysteem voor onderzoek naar virulentie van bacteriële voedselpathogenen
- Wel of niet behandelen: antibioticaresistente Mycoplasma genitalium
- Jaaroverzicht: Seksueel overdraagbare aandoeningen in Nederland in 2021
- Meldingen virologische weekstaten tot en met week 24, 2022
- Meldingen Wet publieke gezondheid tot en met week 24, 2022
- Meldingen virologische weekstaten tot en met week 28, 2022
- Meldingen Wet publieke gezondheid tot en met week 28, 2022
- Meldingen virologische weekstaten tot en met week 32, 2022
- Meldingen Wet publieke gezondheid tot en met week 32, 2022
- Infectieziekten Bulletin